有機化合物の不飽和度の求め方
大学入試の有機の問題では構造決定の問題が定番です。
構造決定の問題の出題パターンは様々ですが、分子式が与えられた場合はまず不飽和度(Degree of unsaturation)を計算して、不飽和結合の数を調べます。
不飽和度は水素不足指数ともよばれます。水素不足指数の表現の方が意味していることを直観的に理解しやすいかもしれません。
計算式は次の通りです。
不飽和度=\(\displaystyle \frac{2C+2+N-H-X}{2}\)
ここで、C、N、H、Xはそれぞれ炭素C、窒素N、水素H、ハロゲン原子Xの数です。
また、酸素(O)や硫黄(S)が存在しても、飽和に必要な水素の数は変わらないので、計算に入れません。
注意としては上記の式は分子式について計算するものです。 組成式(分子における原子の数を最も簡単な整数比で表したもの)は分子の状態を表したものではないため、組成式では当然計算できません。
次に計算式の意味について考えてみます。
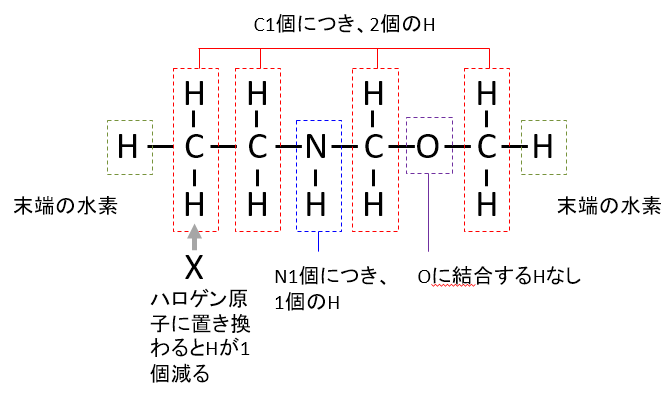
分子が飽和であるときの水素(H)の数は、炭素(C)1個につきHは2個、窒素(N)1個につきHは1個、
さらに分子の両端に1個ずつ、合計2個のHが必要なので
水素Hの数=2C+N+2
となります。
しかしハロゲン原子が含まれているときは水素原子の代わりとなるので、ハロゲン原子の数に応じて必要な水素原子Hの数が減るため、
分子が飽和であるときの水素Hの数=2C+N+2-X
となります。
不足している水素原子2個につき、1個の不飽和結合があることになりますので、 (分子が飽和であるときの水素Hの数)-(分子に実際に含まれているHの数)を2で割ると初めに示した式になります。
イメージは下記のようになります。式を丸暗記ではなく、イメージでも覚えておくとよいです。
不飽和度1個につき二重結合が1個または環状構造が1個あることになります。
また、不飽和度が2以上では三重結合も考えられます。
さらに、ベンゼン環が1個あると不飽和度は3と計算されます。 ベンゼン環がある場合はたいてい「芳香族である」と記載してある場合が多いです。
ここで重要なのは水素が不足している時、二重結合、三重結合だけではなく環状構造も考えられるということです。
環状構造は忘れやすいので、可能性として考えられることをぜひとも覚えておきましょう。
難関大学では環状構造が答えである問題が普通に出題されます。
【まとめ】
不飽和であるとき、下記の可能性が考えられる。
a. 二重結合
b. 三重結合
c. 環状構造
d. ベンゼン環