東京大学 2020年 化学 一問一答と解説
2020年の東京大学の入試問題から一問一答を作ってみました。
----↓ 第1問 Ⅰ----第1問 Ⅰは標準的なレベルの有機化学の問題です。東京大学でなくても出題されそうな問題です。
Q-01.
第1問 Ⅰ ア
天然化合物Aの分子量は286で、炭素、水素、酸素の原子のみからなる。
71.5mgのAを完全燃焼させると、143mgの二酸化炭素と、40.5mgの水が生じた。化合物Aの分子式を示せ。
A-01.
C13H18O7
解説
この年の第一問目は計算問題でした。非常に基本的な問題です。
これと同様の問題は2017年にも出題されています。過去問の演習は大事です。
解法1 71.5 mg中のC, H, Oの重量の内訳を求めて物質量比を求める方法
C: \(\displaystyle 143 \times \frac{12}{44}=39 \) mg
H: \(\displaystyle 40.5 \times \frac{2}{18}=4.5\) mg
O: \(\displaystyle 71.5-39-4.5=28\) mg
C, H, Oの物質量比は \(\displaystyle \frac{39}{12} : \frac{4.5}{1} : \frac{4.5}{16}=3.25: 4.5: 1.75\)
4倍にすると整数になり、C : H : O = 13: 18: 7
(整数にするために、適当な倍数を見つける必要がある。ただし、この問題では求める化合物Aの分子量が286と与えられているので、
71.5 mg / 286 = 0.25 の計算で71.5mgは0.25 mmolとわかるので、1 / 0.25 = 4 で4倍の見当がつく。)
解法2 C, H, Oの物質量比を一気に求める式を立てて計算する方法
この問題の場合、化合物Aの分子量が286と与えられているので、この方法が使えます。
例えば、化合物Aの分子量が○○~□□という条件で与えられているときは、この方法は使えないので、解法1の方法で計算します。
C: \(\displaystyle \frac{143 \times 10^{-3}}{44} \times \frac{286}{ 71.5 \times 10^{-3} }=13 \)
1つ目の分数は、71.5 mg中にCが何モルあるかを計算する式です。
2つ目の分数は、71.5 mgを何倍すれば、化合物A 1 mol (=286 g)になるかを計算する式です。
2つを掛け合わせると化合物A 1molに含まれるCのモル数が求まります。
Hも同様に、
H: \(\displaystyle \frac{40.5 \times 10^{-3}}{18} \times 2 \times \frac{286}{ 71.5 \times 10^{-3} }=18 \)
Oの物質量は化合物A 1molで計算していきます。
O: \(\displaystyle \frac{286-12.0 \times 13-1.0 \times 18 }{16}=7 \)
したがって、 C : H : O = 13: 18: 7
Q-02.
第1問 Ⅰ イ
セロビオース、マルトースを構成する単糖は何か答えよ。
A-02.
グルコース
Q-03.
第1問 Ⅰ イ
スクロースを構成する単糖は何か答えよ。
A-03.
グルコースとフルクトース
Q-04.
第1問 Ⅰ イ
グルコースの分子式を答えよ。
A-04.
C6H12O6
これは、分子量180と共に、覚えておかなければなりません。
Q-05.
第1問 Ⅰ イ
化合物A(C13H18O7)を加水分解して、化合物B(C6H12O6)ができるとき、
化合物Bと共にできる化合物Cの分子式を求めよ。
A-05.
C7H8O2
計算方法
C13H18O7 + H2O - C6H12O6 = C7H8O2
加水分解なので、C13H18O7に H2Oを足し(水を加える)、化合物Bの分子式を引く。
加水分解に関連して、分子式を求める問題はよく出題されるので、やり方を覚えておかなければならない。
Q-06.
第1問 Ⅰ イ
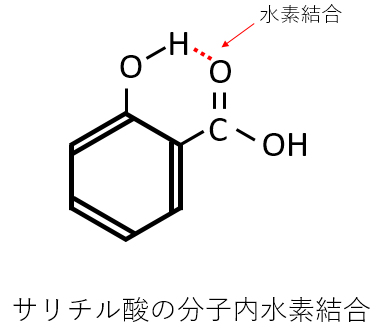
サリチル酸は分子内で水素結合を形成しているか。
A-06.
水素結合を形成している
Q-07.
第1問 Ⅰ ウ
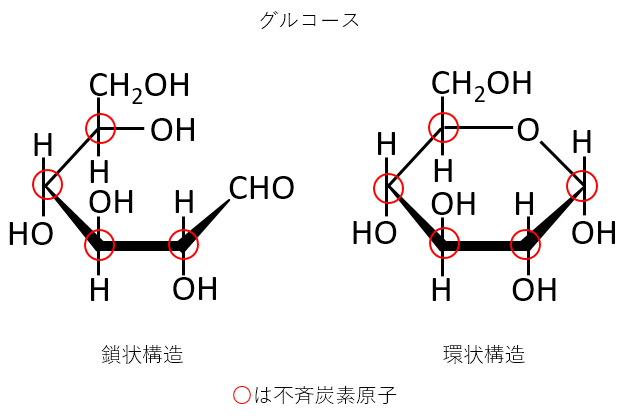
グルコースの鎖状構造と六員環構造における不斉炭素原子の数を答えよ。
A-07.
鎖状構造 4個
六員環構造 5個
知っているかどうかを問うストレートな問題です。
Q-08.
第1問 Ⅰ エ
フェーリング反応について説明せよ。
A-08.
フェーリング液(青色)中のCu2+が還元されてCu2Oの赤色沈殿(赤褐色沈殿)ができる反応。
-CHO基(ホルミル基、(アルデヒド基))の検出などに使われる。
Q-09.
第1問 Ⅰ エ
セロビオース、マルトース、スクロースの中でフェーリング液を還元するものをすべて答えよ。また、その理由を述べよ。
A-09.
セロビオース、マルトース
セロビオースとマルトースは水溶液中で開環して、還元性のあるホルミル基(アルデヒド基) が生成するから。
Q-10.
第1問 Ⅰ オ
分子式がC7H8O2で表される化合物の中で、酸化することによってサリチル酸が得られるものの構造式を示せ。
A-10.
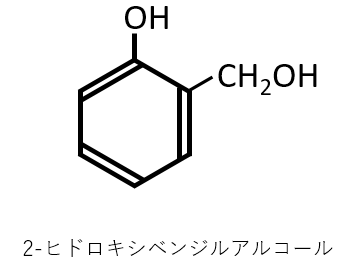
名前は覚える必要はありません。
Q-11.
第1問 Ⅰ カ
化合物Aはβ-グルコースと2-ヒドロキシベンジルアルコールが脱水縮合してできた物質である。化合物Aは還元性を示さず、またフェノール類でない(フェノール性-OHがない)とき 、化合物Aの構造を示せ。

A-11.
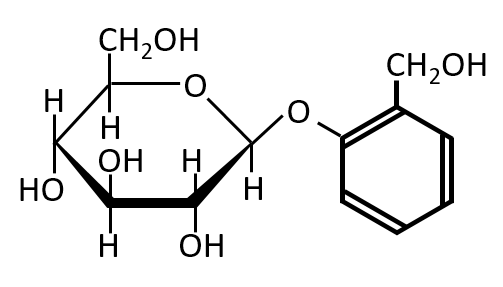
求める化合物Aは、還元性を示さないのでグルコースの1位の炭素が結合しており、またフェノール類ではないので、2-ヒドロキシベンジルアルコールのベンゼン環に直接結合した-OHが反応して結合したもの。
この一問一答では、2つの物質を示し、Aの構造を決定するという問題にしましたが、実際の入試問題ではグルコースがβ形であると判断するのが難しい設定になっていました。
第1問Ⅰの中で最も難しく、東大レベルの問題でした。
----↓ 第1問 Ⅱ----
第1問 Ⅱはかなり難しい問題です。
通常、ヨードホルム反応の問題では、ヨードホルム反応を示す有機物の構造や、ヨードホルムについて聞かれることが多いですが、この問題ではCHI3と共にできる有機物について聞かれています。少なくとも、どのような構造のものができるのか知っていなければ解答できません。
さらにこの問題では一般的に教科書に書いてある構造の有機物以外にも別の有機物ができる設定となっているため、余計に混乱が生じて難しくしています。
なお、通常とは別の有機物については、ヨードホルム反応ではない、別の条件から推定して解答することになります。
本問題は東京大学の研究グループがヨードホルム反応を利用した有機化合物の合成の研究として2017年にNatureのScience Reportsに投稿した、非常に新しい論文が元になっているようです。
Ryosuke Kawasumi, Shodai Narita, Kazunori Miyamoto, Ken-ichi Tominaga, Ryo Takita & Masanobu Uchiyama, One-step Conversion of Levulinic Acid to Succinic Acid Using I2/t-BuOK System: The Iodoform Reaction Revisited. Sci Rep 7, 17967 (2017). https://doi.org/10.1038/s41598-017-17116-4
以下は余談です。
ヨードホルム反応は大学入試ではよく扱われる題材です。しかし、大学で有機化学の教科書としてよく使用される、ボルハルト・ショアー「現代有機化学」上、下(化学同人)の最新版の第8版 (2019)には、ハロホルム反応は載っていません(この反応はヨウ素以外の他のハロゲンでも起こるため、一般的にハロホルム反応といいます)。
ただし、「ケトンのハロゲン化」については、詳しく説明されています。
ちなみに、ボルハルト・ショアー「現代有機化学」の古い版には、ハロホルム反応やヨードホルム反応がメチルケトンの検出法として紹介されています。
しかし、機器分析が進んだ現代では、ハロホルム反応はメチルケトンの検出方法として使われません。
Q-12.
第1問 Ⅱ キ
アセトンに過剰量の水酸化ナトリウムとヨウ素を反応させたときにできる特有の臭気をもつ黄色の化合物は何か。
A-12.
CHI3、ヨードホルム
Q-13.
第1問 Ⅱ ク
エチレングリコールの構造式を示せ。
A-13.
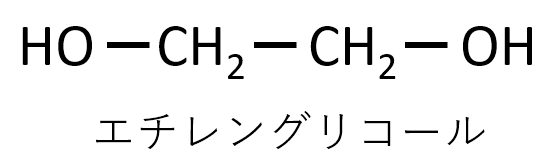
-CH2-CH2-の両側にOH
Q-14.
第1問 Ⅱ ク
直鎖状化合物Jとエチレングリコールを混合して縮合させたとき、物質量 1:1でエステル結合した高分子Hが得られた。高分子Hの平均重合度が100、平均分子量が1.44×104のとき、化合物Jの分子量を求めよ。
A-14.
118
解法
高分子Hの構造を書くところから始めます。こういう問題は適当にやってしまうと間違う可能性が高くなるので、構造式を書いて正確に進めていくのが良いです。
高分子Hは、直鎖状化合物Jとエチレングリコールがエステル結合してできているため、直鎖状化合物Jの未知の部分をRとすると、下記のようになります。
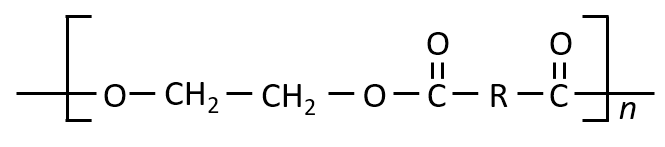
両端も注意して構造を正確に書きます。
重合度が100ということは、上の式のnが100ということです。
Rを除く部分の分子量は116です。高分子の分子量で方程式を作ると
(116+R)×100=1.44×104
R=28
となります。
Jの構造はHOOC-R-COOHなので、分子量は118となります。
Q-15.
第1問 Ⅱ コ
水分子が1個とれたとき、フマル酸ができる化合物の構造を示せ。
A-15.
答え
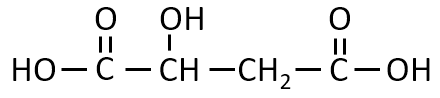
解説
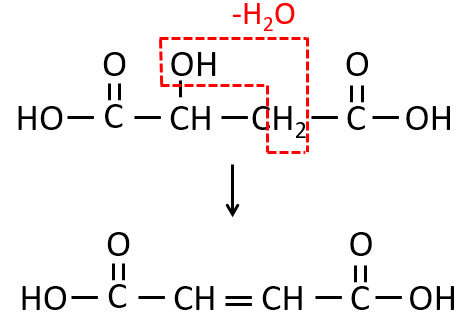
Q-16.
第1問 Ⅱ サ
下記の化合物がヨードホルム反応をした時、CHI3と共にできる化合物の構造(液を酸性にした後の構造)を示せ。
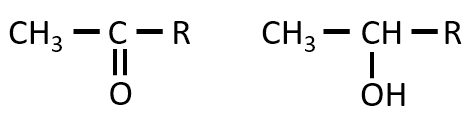
A-16.
答え
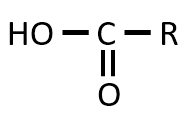
解説
CH3の部分の炭素原子がCHI3となって取れて、代わりに-OHが付く。炭素原子が1個とれるため、元の化合物と比べて、炭素原子が1つ少ない有機物ができる 。
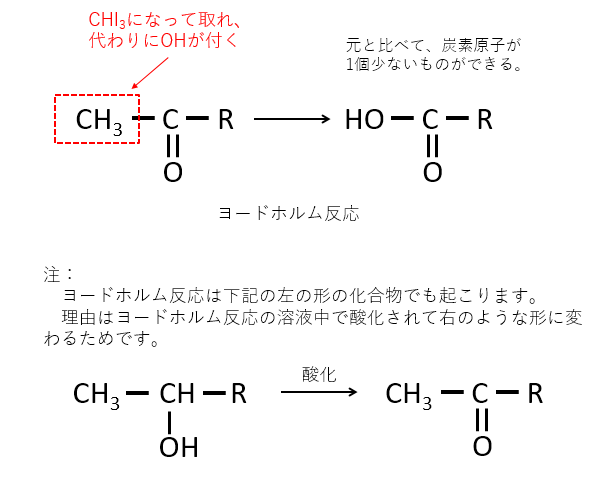
ヨードホルム反応の通常の解説ではHOOC-Rができることが記されています。しかし、第1問 Ⅱではこれ以外のものができる設定になっています。
ヨードホルム反応は複雑な反応ですので、本問題の答えのような化合物もできるのでしょう。
何らかの論文をもとに問題を作成されたのでしょうか。
(追記:やはり元となっている論文がありました。
Ryosuke Kawasumi, Shodai Narita, Kazunori Miyamoto, Ken-ichi Tominaga, Ryo Takita & Masanobu Uchiyama, One-step Conversion of Levulinic Acid to Succinic Acid Using I2/t-BuOK System: The Iodoform Reaction Revisited. Sci Rep 7, 17967 (2017). https://doi.org/10.1038/s41598-017-17116-4)
----↓ 第2問 Ⅰ----
第2問 Ⅰは割と取り組みやすい問題でした。1問だけ計算問題がありますが、考えかたが難しい問題ではありませんでした。
最後の問題のCO2の還元反応とH2O酸化反応の反応式を書く問題は、本来そんなに難しい問題ではありませんが、問題の問い方が分かりにくいため、答えにくくなっています。
Q-17.
第2問 Ⅰ ア
希ガスは何個の価電子をもつか答えよ。
A-17.
0
解説
2や8ではありません。
Q-18.
第2問 Ⅰ ア
すべての原子のうちで最も大きな第1イオン化エネルギーを持つ原子は何か答えよ。
A-18.
He
解説
一般的に、第1イオン化エネルギーは周期表の右上ほど大きい。
Q-19.
第2問 Ⅰ エ
赤熱したFeとH2Oの反応式を示せ。
A-19.
3Fe + 4H2O → Fe3O4 + 4H2
Q-20.
第2問 Ⅰ エ
NH4NO2を加熱してN2が生成する反応式を示せ。
A-20.
NH4NO2 → N2 + 2H2O
Q-21.
第2問 Ⅰ エ
NH4NO2 → N2 + 2H2O の反応において、反応前後の窒素原子の酸化数を答えよ。
A-21.
反応前 -3と+3
反応後 0
解説
NH4+中のNは-3、NO2-中のNは+3
N2中のNの酸化数は0
Q-22.
第2問 Ⅰ エ
CO2の還元反応とH2Oの酸化反応の組み合わせでHCOOHとO2ができるとき、
それぞれの反応を電子e-を用いた反応式で示せ。(人工光合成の反応として出題されている。エネルギーを加えないと起こらない反応である。)
A-22.
CO2 + 2H+ + 2e- → HCOOH
2H2O → O2 + 4H+ + 4e-
解説
CO2がHCOOH、H2OがO2になると書いてあれば簡単な問題ですが、問題文の書き方で難しい問題となっています。
CO2を還元した時の反応は、本設問以外にもいろいろ考えられる。
CO2 + e- → CO2・-
CO2 + 2H+ + 2e- → CO + H2O
CO2 + 4H+ + 4e- → HCHO + H2O
CO2 + 6H+ + 6e- → CH3OH + H2O
CO2 + 8H+ + 8e- → CH4 + 2H2O
(参考文献: 光学 41巻 6号 (2012) 324)
----↓ 第2問 Ⅱ----
第2問Ⅱの中で難しかったのは、電子式の構造から分子の形を推定する問題です。高校の範囲を超えているので、リード文の説明を読んで理解した後、答える問題ですが、 これは過去にやったことがなければ、何のことか理解できず、解答することはできなかったのではないでしょうか。
Q-23.
第2問 Ⅱ キ
HCN分子、亜硝酸イオンNO2-の電子式を示せ。
A-23.
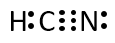
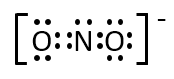
Q-24.
第2問 Ⅱ ク
NO2+、O3、N3-の電子式を示せ。
A-24.
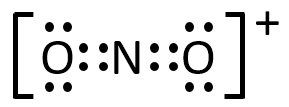
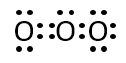
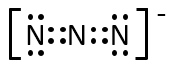
----↓ 第3問 Ⅰ----
第3問Ⅰは、炭酸水素ナトリウムNaHCO3の電離平衡に関する問題でした。物質量と電荷について等式を立てることができることがポイントとなります。
電荷の式では、イオンの価数に応じて係数をつけることを忘れないようにする必要があります。
またこの類の問題は、極端に濃度が低いイオンや化合物は、計算していく上で省略していく必要があります。
緩衝液の作用など非常に基本的な出題もありました。
Q-25.
第3問 Ⅰ イ
炭酸の二段階電離を表す式は下記の通りである。
H2CO3 ⇄ H+ + HCO3- K1=
HCO3- ⇄ H+ + CO32- K2=
電離定数K1、K2を表す式を答えよ。
A-25.
\(\displaystyle K_1= \frac{[H^{+}][HCO_3^{\ -}]}{[H_2CO_3]} \)
\(\displaystyle K_2= \frac{[H^{+}][CO_3^{\ 2-}]}{[HCO_3^{\ -}]} \)
Q-26.
第3問 Ⅰ イ
炭酸水素ナトリウムNaHCO3を水に溶かしたとき、
①物質量の関係から導かれる等式
②電気的中性の関係から導かれる等式
を示せ。
水溶液中のイオンや化合物の濃度は、例えば[Na+] 、[H2CO3]などと表すものとする。
ただし、炭酸の二段階電離を表す式は下記の通りである。
H2CO3 ⇄ H+ + HCO3-
HCO3- ⇄ H+ + CO32-
A-26.
①物質量の関係から導かれる等式
[Na+] = [H2CO3] + [HCO3-] + [CO32-]
水に溶かした直後は、Na+と同量のHCO3-のみ存在しますが、HCO3-の一部は問題に示した電離の式により
H2CO3やHCO3- に変化していきます。しかし、HCO3-一分子が消滅して
H2CO3、またHCO3-一分子が消滅してCO32- が生成するので、水に溶かした直後の
[HCO3-]と平衡状態になったときの [H2CO3] + [HCO3-] + [CO32-]は
等しくなります。
[Na+] =の式において[H+ ]は考慮する必要がありません。[H2CO3] 、[HCO3-]、
[CO32-]で等式を成立させることができます。
②電気的中性の関係から導かれる等式
[Na+] + [H+]= [HCO3-] + 2[CO32-] + [OH-]
水の中にあるイオンを書いて考えます。したがって、[H+]と[OH-]も式に入れます。
この式で重要なのは[CO32-] を2倍する必要があるということです。なぜかというと、CO32-は2価のイオン
だからです。電荷の計算をしており、単なる物質量の計算ではありません。
----↓ 第3問 Ⅱ----
第3問Ⅱも解答するのに困るような問題はありませんでした。非常に標準的な内容だと思います。
計算問題で計算間違いなく、また、熱化学方程式の反応熱を計算するとき、物質の状態、反応式の係数に注意して解答すれば、ほとんど正解できるのではないでしょうか。
Q-27.
第3問 Ⅱ ク
SO2(気)、H2S(気)、H2O(液)の生成熱をそれぞれ296.9 kJ /mol、20.2 kJ /mol、285.8 kJ /mol、H2O(液)の蒸発熱を44.0 kJ /molとする。
下記の反応の熱化学方程式を示せ。
SO2(気)+ 3H2(気)⇄ H2S(気)+ 2H2O(気)
A-27.
SO2(気)+ 3H2(気)= H2S(気)+ 2H2O(気)+ 206.9 kJ
解説
丁寧に書くと
H2(気)+ 1/2 O2(気)= H2O(液)+ 285.8 kJ
H2O(液)= H2O(気)- 44.0 kJ
から、
H2(気)+ 1/2 O2(気)= H2O(気)+ 241.8 kJ
SO2(気)+ 3H2(気)⇄ H2S(気)+ 2H2O(気)の反応熱は
反応熱=(右辺の化合物の生成熱)ー(左辺の化合物の生成熱)
=(20.2+2×241.8)-296.9
=206.9
(H2Oについて、2倍するのを忘れないようにしなければならない。)
反応熱を、
反応熱=(右辺の化合物の生成熱)ー(左辺の化合物の生成の和)
で求めるとき、この問題において、H2O(液)の値を使って計算してはいけません。H2O(気)の生成熱を求めて計算する必要があります。
H2O(気)とH2O(液)の生成熱の関係はどうなっているのかというと、H2O(気)の生成熱は、H2O(液)の生成熱285.8 kJ /molから蒸発熱44.0 kJ /molを引いたものになります。
図に書くと下のようになります。この図を参考にして蒸発熱の足す、引くを間違えないようにしましょう。
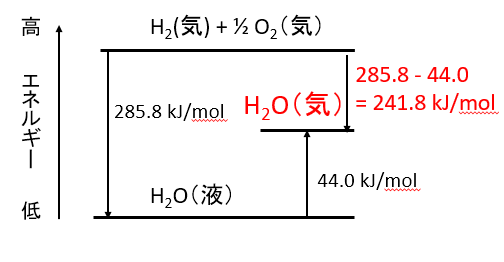
Q-28.
第3問 Ⅱ コ
SO2とH2Sの反応式を示せ。
A-28.
SO2 + 2H2S → 3S + 2H2O
解説
Sが析出するという問題として出題されました。