東京大学 2019年 化学 一問一答と解説
2019年の東京大学の入試問題から一問一答を作ってみました。
----↓ 第1問 ----
第1問Ⅰは有機化学の問題です。前半はフェノールを出発原料とした構造推定、後半はフェノール樹脂です。問題はつながっていますが前半と後半は、 「フェノール」は共通ですが、問題としてはそれぞれ独立しています。
前半の有機化学の問題は解答していく上で、いくつか関門があります。フェノールから出発して、いろいろな中間体を経て医薬品の原料を合成する という設定になっています。
まず初めに、リード文では、「フェノールでは、様々な置換反応がベンゼン環上の特定の位置で起こりやすい」と書いてあります。 これは置換反応を考えるとき、オルト、メタ、パラ配向も考えて答えよということです。
ここを見落とすと、構造式を答えるとき可能性のあるものはすべて答えるべきか、配向を考えて答えるべきか分からなくなります。
次に、フェノールに希硝酸や濃硝酸と濃硫酸を反応させます。フェノールではなく、ベンゼンに硝酸と硫酸を反応させて ニトロベンゼンができるというのは初歩的な知識として覚えていると思ます。ベンゼンの反応だけを覚えていると、この問題の設定ではいきなり混乱が生じます。
反応させるのはベンゼンではなくフェノールです。フェノールはベンゼンに比べて置換反応が起こりやすいので、希硝酸を反応させる だけで-NO2が1個置換したものができます。濃硝酸と濃硫酸はそれよりも激しい反応条件となりますので、 ベンゼン環に-NO2が3個置換したものができます。
まず、このベンゼンとフェノールの差に気付くかどうかがポイントとなります。
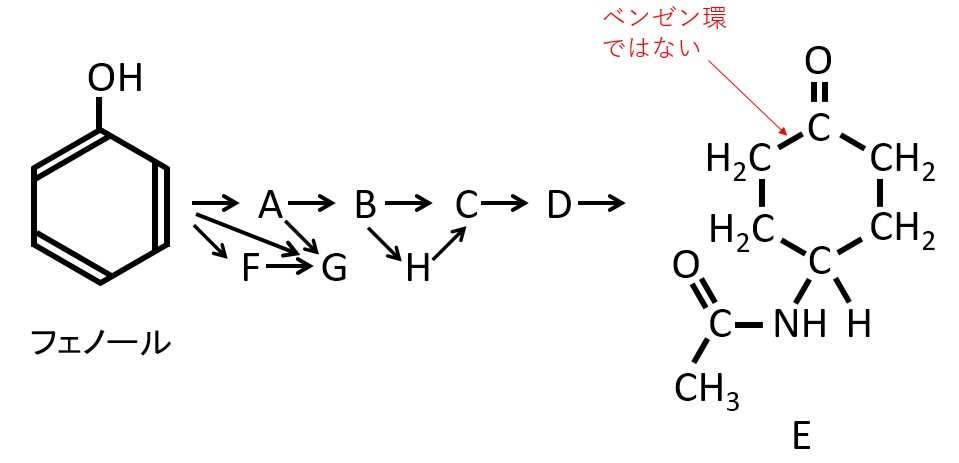
最後にできる化合物は炭素が6個環状につながった構造の図が書いてあります。この図の化合物では、 6個の炭素が環状につながったものはベンゼン環ではありません。環状飽和炭化水素の構造です。慌てて、ベンゼン環と勘違いしないようにしなければなりません。
初めフェノールから出発しているので、勝手な思い込みで最後もベンゼン環と決めないようにしなければなりません。
Q-01.
Q. 第1問 ア
フェノールでは、様々な置換反応がベンゼン環上の特定の位置で起こりやすい。
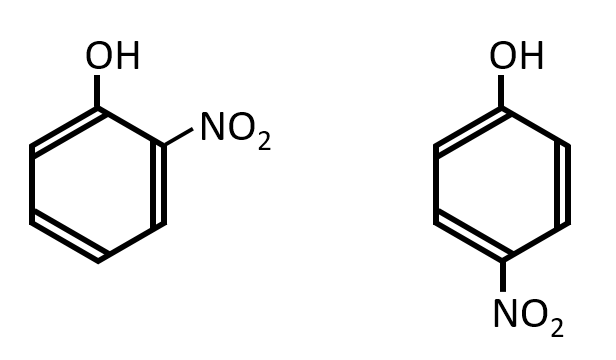
フェノールに希硝酸を作用させると互いに同じ分子式を持つ化合物Aと化合物Fが得られた。
化合物Aと化合物Fの構造式を答えよ。
A-01.
オルト位またはパラ位が-NO2で置換する。
ベンゼンと違い、フェノールの場合は希硝酸で-NO2の置換反応が起こる。
Q-02.
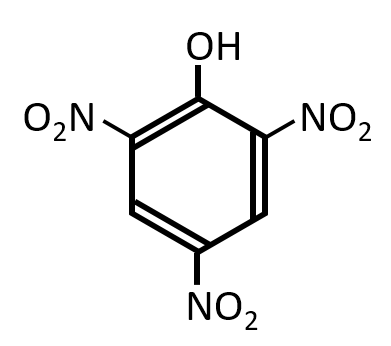
第1問 イ
フェノールに、濃硝酸と濃硫酸の混合物を加えて加熱し、十分反応させると、化合物Gが得られた。化合物Gの構造式を答えよ。
A-02.
希硝酸よりも激しい条件なので-NO2が3個置換した化合物ができる。
Q-03.
第1問 ウ
下記の構造の化合物を濃塩酸中で鉄と処理した。その後、炭酸水素ナトリウム水溶液を加えたところ、二酸化炭素が気体として発生した。
この時得られた化合物の構造式を答えよ。
A-03.
-NO2が還元されて-NH2になる。ニトロベンゼンに塩酸とスズを作用させてアニリンを作るときの類推。
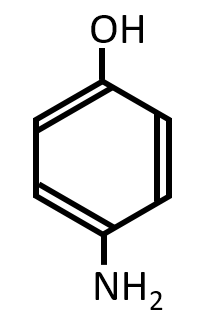
Q-04.
第1問
ウ下記の構造の化合物に、希硫酸中で無水酢酸と反応させてできる化合物Hの構造式を示せ。
ただし、化合物Hは塩化鉄(Ⅲ)水溶液で呈色しなかった。

A-04.
まず無水酢酸は、CH3CO-の部分が-NH2と反応します。さらにこの反応条件では-OH基とも反応して
下記の構造の化合物となります。
反応させるのは酢酸ではありません。反応性が高い無水酢酸です。
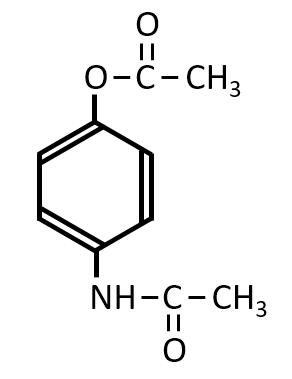
Q-05.
第1問 ウ
下記の構造の化合物に、水中で無水酢酸と反応させてできる化合物Cの構造式を示せ。

A-05.
希硫酸中の時と異なり、無水酢酸のCH3CO-の部分が-NH2とのみ反応します。
反応させるのは酢酸ではありません。反応性が高い無水酢酸です。
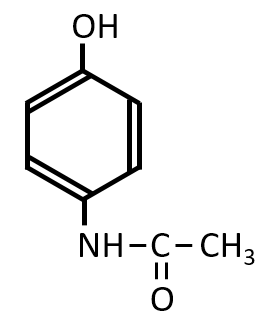
Q-06.
第1問 エ
下記の構造の化合物に、ニッケルを触媒として水素を作用させたときにできる化合物Dの構造式を示せ。
また、化合物Dには立体異性体が、いくつ存在するか答えよ。

A-06.
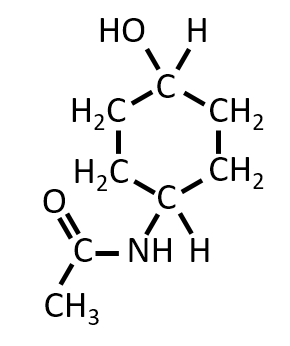
立体異性体の数 2
解説
化合物Dには不斉炭素原子はありませんが、下記のように2つの立体異性体があります。
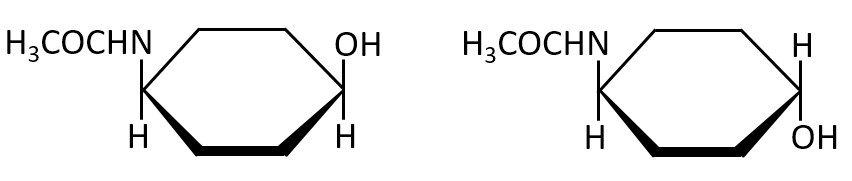
この問題では、立体異性体がいくつ存在するか、と書かれています。立体異性体の中には、幾何異性体と光学異性体があります。
Q-07.
第1問 エ
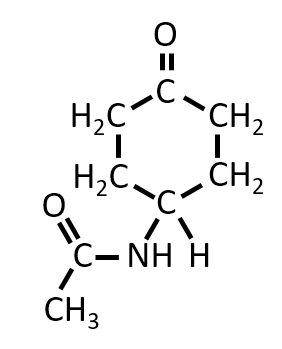
下記の構造の化合物に、硫酸酸性の二クロム酸カリウム水溶液を作用させたときにできる化合物の構造式を答えよ。

A-07.
-OH基が酸化されてC=O二重結合ができる。
----↑ 第1問 ----
----↓ 第2問 Ⅰ----
第2問 Ⅰはリン関係の問題です。初めは無機化学としてのリン、後半はリン酸型燃料電池の問題です。リンつながりで問題が進行していく凝った作りとなっています。
第2問の中で難しい問題は、通常の参考書では載っていない十酸化四リンの構造を書く問題でした。途中まで構造が書いてあるものの、知っていないとなかなか解答するのは難しかったのではないでしょうか。
燃料電池は学習していく上でマイナーな項目かもしれません。第2問Ⅰの問題は知っていれば簡単に解答できますが、逆に知らないと反応式を書くことができず、その後の問題も解答できません。
Q-08.
第2問 Ⅰ ア
2Ca3(PO4)2 + 10C → P4 + 10CO + 6CaO
上記の反応は、十酸化四リンを生成する第一段階の反応と、十酸化四リンと炭素の間の第二段階の反応の組み合わせとして理解できる。
それぞれの反応の化学反応式を示せ。
A-08.
2Ca3(PO4)2 → P4O10 + 6CaO
P4O10 + 10C → P4 + 10CO
解説
Q.に書いたのは実際に試験に出題された文そのままです。
この文を読むと???ですが、問題文が意味するところは、Ca3(PO4)2 が反応してP4O10ができる反応と、 P4O10 とCが反応する反応式を書けということです。
最後にできる気体がCO2ではなく、COである点に注意。
Q-09.
第2問 Ⅰ イ
十酸化四リン(P4O10)の構造をかけ。
A-09.
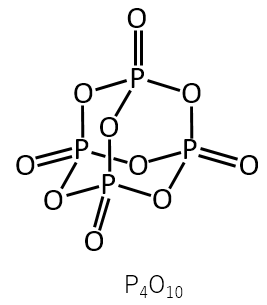
解説
実際の問題は、構造の一部が書いてあって、残りの部分を付け加えて完成させる問題でした。
十酸化四リン(P4O10)の構造は、普通の参考書には載っていないと思いますので、第2問Ⅰの中では最も難しかった問題ではないでしょうか。
Q-10.
第2問 Ⅰ ウ
燃料電池の負極と正極で反応する気体を答えよ。
A-10.
負極: 水素
正極: 酸素
解説
勢いで覚える語呂:燃料電池は、負すい、正さん
燃料電池は水素と酸素を反応させてエネルギーを取り出す電池。水素と酸素が反応した結果、水が生成する。
Q-11.
第2問 Ⅰ ウ
リン酸型燃料電池の正極、負極の反応式をかけ。
A-11.
負極
H2 → 2H+ + 2e-
正極
O2 + 4H+ + 4e- → 2H2O
解説
リン酸型燃料電池は電解液が酸性です。
負極で反応するのは水素、正極で反応するのは酸素です。これはリン酸型、アルカリ型共通です。
リン酸型燃料電池ではH+が両極間を移動し、反応します。
今回の出題はリン酸型燃料電池の出題でしたが、燃料電池はアルカリ型もあり、反応式が少し異なります。
この際に覚えておきましょう。
アルカリ型 KOH水溶液
負極
H2 + 2OH- → 2H2O + 2e-
正極
O2 + 2H2O + 4e- → 4OH-
燃料電池は流行であることもあり、近いうちにまた出題されるかもしれません。
----↑ 第2問 Ⅰ----
----↓ 第2問 Ⅱ----
第2問 Ⅱは無機化学の問題です。解答しやすい問題が多いため、得点源となる問題だったと思います。
Cu2+イオンとFe3+イオンを含む水溶液からFe3+のみ沈殿させるためには? の頓智のような
問題にうまくひらめくことができたかどうかがポイントでしょう。答えを見ればとても簡単な内容です。
最後の計算問題も、難しいような、簡単なようなどちらともつかない問題でした。
Q-12.
第2問 Ⅱ カ
CuFeS2を酸素とともに強熱すると気体が発生し、硫黄を含まない固体が得られた。気体は水に溶解することで亜硫酸水溶液として除去した。発生した気体の化学式を答えよ。
A-12.
SO2
Q-13.
第2問 Ⅱ キ
Cu2+イオンとFe3+イオンを含む水溶液に金属を加えて、Cu2+イオンのみ還元させたい。
この時、カリウムが使えない理由を二つ述べよ。
A-13.
カリウムは水と反応するから。
イオン化傾向が鉄よりも大きいから。
実際の問題は、まず初めに、ニッケル、スズ、鉛、カリウムの中から、Cu2+イオンの還元に使えない金属を選択するところから始まります。
Q-14.
第2問 Ⅱ ク、ケ
Cu2+イオンとFe3+イオンを含む水溶液において、過剰量の塩基性水溶液を加えると、銅を含まない赤褐色の固体が得られた。
加えた塩基性水溶液は何か答えよ。
また赤褐色の固体は何か答えよ。
A-14.
アンモニア水
Fe(OH)3
解説
水酸化ナトリウムのような塩基を加えると、Cu(OH)2とFe(OH)3が沈殿するが、アンモニア水だとCu2+は[Cu(NH3)4]2+となって沈殿しない。
Q-15.
第2問 Ⅱ コ
Fe2O3をメタンの存在下で強熱したところ、純粋な鉄が得られた。同時に二酸化炭素と水が生成した。
この時の反応式を示せ。
A-15.
4Fe2O3 + 3CH4 → 8Fe + 3CO2 + 6H2O
解説
東大の問題に特徴的な、係数が複雑な化学反応式です。
反応式が問われている問題において、すべての反応式の係数が複雑なわけではありませんので、丁寧に計算すべきか、簡単に係数を合わせることができるか判断しなければなりません。
----↑ 第2問 Ⅱ----
----↓ 第3問 Ⅰ----
第3問 Ⅰは酸化還元滴定の問題でした。
試料の原液から一部を取ったり、薄めたりなど複雑な工程を経て、滴定に使う液を作製する設定になっています。
滴定の計算は難しくないですが、液の作り方を落ち着て整理しておかないと、原液中のヨウ素の濃度を正しく求められません。
Q-16.
第3問 Ⅰ ア
ヨウ素(I2)とチオ硫酸ナトリウム(Na2S2O3)が反応し、
テトラチオン酸ナトリウム(Na2S4O6)が生じる。この反応式を記せ。
A-16.
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Q-17.
第3問 Ⅰ イ
硫化鉄と硫酸が反応したときにできる気体は何か答えよ。
A-17.
硫化水素(H2S)
FeS + H2SO4 → FeSO4 + H2S
Q-18.
第3問 Ⅰ イ
硫化水素とヨウ素との間で起こる反応を化学反応式で記せ。
また、反応の前後で酸化数が変化したすべての元素を反応の前後の酸化数とともに記せ。
A-18.
H2S + I2 → 2HI + S
S: -2 → 0
I: 0 → -1
----↑ 第3問 Ⅰ----
----↓ 第3問 Ⅱ----
第3問Ⅱは結晶の問題でした。 結晶の組成は勝手に判断せず、図を見て正確に原子の数を数える必要があります。
原子の種類を変更した時の結晶構造の問題も、図を書いて考えないと間違えます。
第3問Ⅱは計算問題がありますが、答える数値は小数点以下3桁です。有効数字3桁ではありません。問題をよく読まないと正しい答えを解答できません。
第3問Ⅰは有効数字が指定してありました。その流れでこの問題も有効数字3桁で答えてはいけません。
Q-19.
第3問 Ⅱ カ
図のイオン結晶の組成式をMA、MB、Xを用いて表せ。
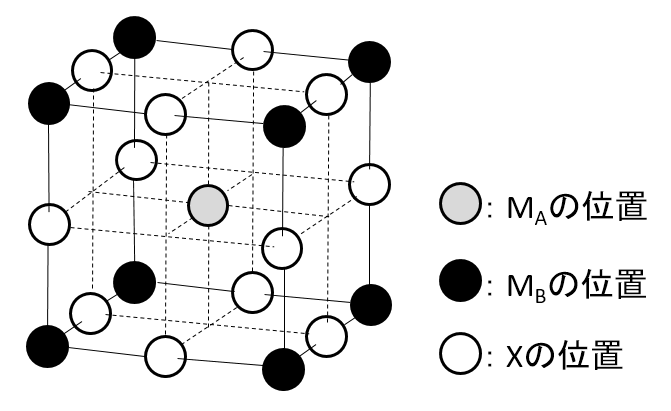
A-19.
MAMBX3
解説
MAの数 1
MBの数 1
Xの数 3
Q-21.
第3問 Ⅱ キ
図のイオン結晶のMA、MBの配位数を答えよ。

A-21.
MAの配位数: 12
MBの配位数: 6
Q-22.
第3問 Ⅱ ク
図のイオン結晶において、MAとXをすべて原子Yに置き換え、すべてのMBを取り除いたとする。このとき、Yの配列は何と呼ばれるか答えよ。

A-22.
面心立方格子
解説
まず初めに問題文の通りに図を描きます。MAとXをすべて原子Yに置き換え、すべてのMBを取り除いたのが下の図になります。
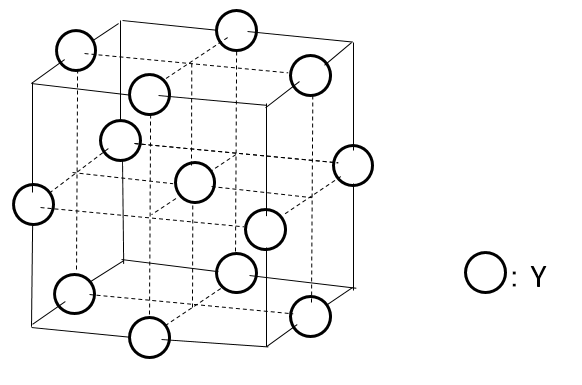
このままだとよく分かりませんので構造を追加して描きます。下の図では元の図に対して上面方向を追加して描いてあります。
結晶は規則正しい原子の配列の繰り返しでできています。原子の並びを上方向に再現すると下図の左の図になります。
追加したところと元々あったところで構造を見ると面心立方格子となっていることが分かります。
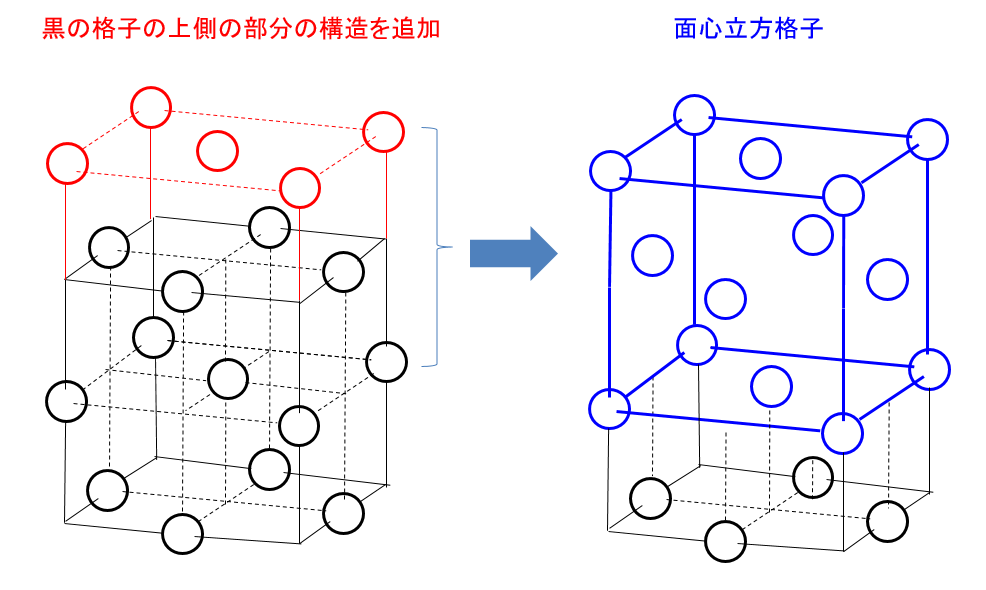
----↑ 第3問 Ⅱ----