東京大学 2018年 化学 一問一答と解説
2018年の東京大学の入試問題から一問一答を作ってみました。
----↓ 第1問 ----
第1問はアミノ酸の化合物に関する有機化学の問題です。ジペプチドが環状につながったジケトピペラジンというものを 題材にしています。ジケトピペラジンなるものは高校では扱わないので、リード文を読んで理解しながら解答を進める問題です。 大半は構造決定の問題ですが、解答にかなり時間がかかる面倒な問題もあります。 また環状化合物の異性体の数を答える問題も、通常の問題集では出てこないものなので、非常に難しいと思ます。
Q-01.
第1問 問ア
エタノールとナトリウムとの反応の化学反応式を示せ。
A-01.
2C2H5OH + 2Na → 2C2H5ONa + H2
Q-02.
第1問 イ
A-02.
S、硫黄
Q-03.
第1問 エ
S-Sの結合を何というか答えよ。
A-03.
ジスルフィド結合
Q-04.
第1問 エ
側鎖に-CH2-SHを持つアミノ酸同士は何という結合をつくるか答えよ。
A-04.
ジスルフィド結合
Q-05.
第1問 エ
-CH2-SHを持つアミノ酸同士から-CH2-S-S-CH2-の結合をつくるためにはどうすればよいか。
A-05.
酸化剤を用いる(過酸化水素)。
2R-CH2-S-H → R-CH2-S-S-CH2-R + 2H+ + 2e-(Hを失う反応は酸化)
Q-06.
第1問 エ
-CH2-S-S-CH2-の結合切って-CH2-SHに分解するためにはどうすればよいか。
A-06.
還元剤を用いる。
Q-07.
第1問 オ
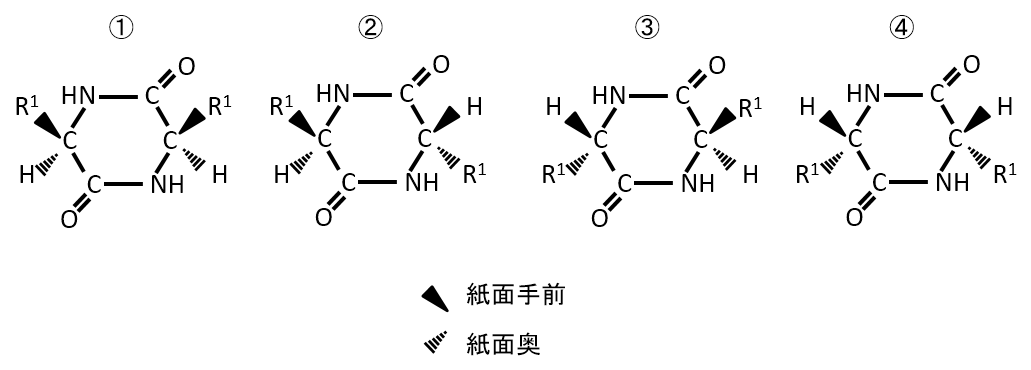
下記の化合物の立体異性体を答えよ。
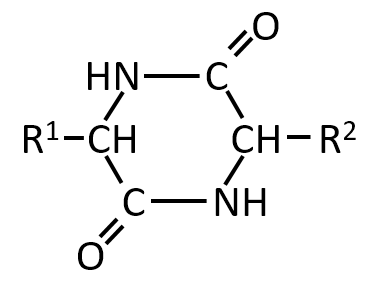
A-07.
環に結合しているR1とH、R2とHの上下の違いによりの下記の4種類がある。
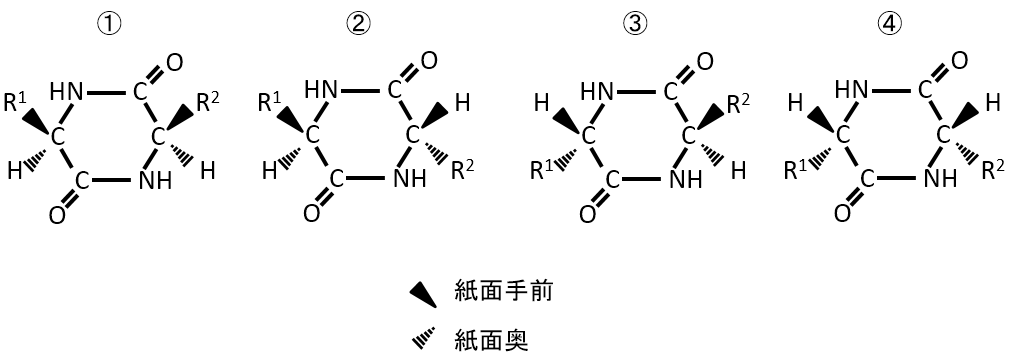
解説
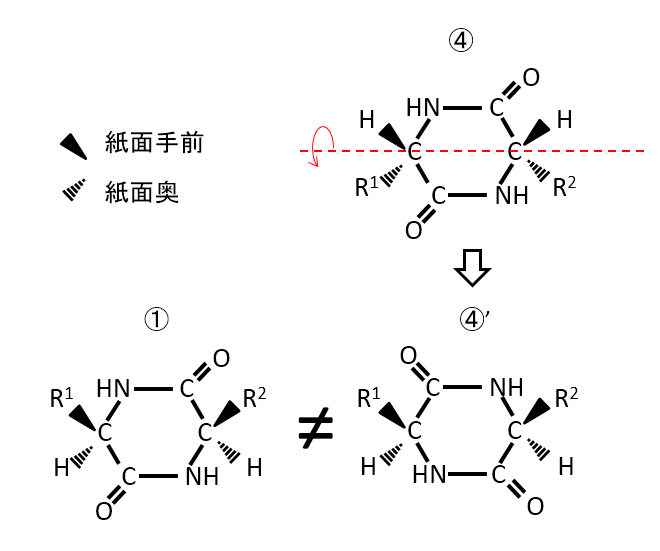
例えば、①と④は異なる化合物である。④の化合物を裏表反転させると④'になる。R1とH、R2とHの上下関係は同じになるがC=Oの位置が異なるため、①と④は重ならない。
Q-08.
第1問 オ
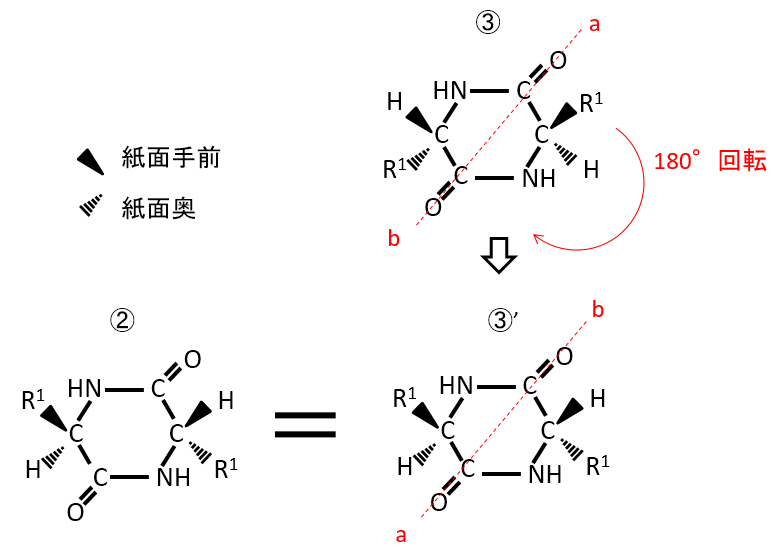
下記の化合物の立体異性体を答えよ。
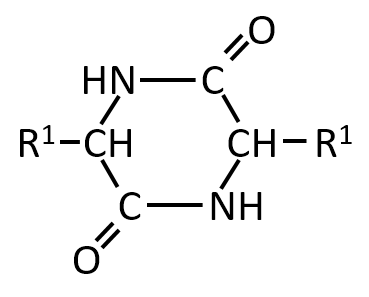
A-08.
先ほどの問題と同様に考えると、R1とHの上下関係で下記の4種類となる。しかし、③を紙面上で180°回転させると③'となり、
これは②と同じであるため、立体異性は下記の①、②(③)、④の3種類となる。
----↑ 第1問 ----
----↓ 第2問 ----
第2問は無機化学系のいろいろな混合問題です。内容は化学反応、結晶、融解塩電解などです。
難易度は高くなく、取り組みやすい問題が多かった印象です。
Q-09.
第2問 ア
消石灰Ca(OH)2の水溶液に適量のCO2を吹き込んで得られる白色沈殿を取り出し、
これを強熱して生石灰CaOが生じる反応があげられる。Ca(OH)2から白色沈殿が生成する反応と、
白色沈殿からCaOが生成する反応のそれぞれについて化学反応式を示せ。
A-09.
Ca(OH)2 + CO2 → CaCO3 + H2O
CaCO3 → CaO + CO2
Q-10.
第2問 ウ
MgO、CaO、BaOの結晶のうち、最も融点の高いものを推定し、理由を示せ。
A-10.
MgO
いずれの陽イオンも2価であるため、3つの結晶で陽イオンと陰イオンの距離を比較すると、Mg2+の
イオン半径が最も小さいため、陽イオンと陰イオンの距離はMgOが最も短くなるので、クーロン力が最も強く働き、結合する力が最も高いため。
Q-11.
第2問 エ
Alの単体を酸化してAl2O3を得るときの酸化物と単体の体積比( =酸化物の体積÷単体の体積)を、有効数字2桁で求めよ。
ただし、Alの原子量 27.0、Oの原子量 16.0、Alの密度 2.70 g/cm3、Al2O3の密度 3.99 g/cm3 とする。
A-11.
1.3
解説
Al 1 molで考える。Al 1 molの重量は27.0 gのため体積は27.0/2.70 cm3。
Al 1 molからAl2O3が0.5 molできるため、(27.0×2+16.0×3)×1/2 gのAl2O3ができる。
体積は、(27.0×2+16.0×3)×1/2 ÷ 3.99 cm3である。
したがって、酸化物と単体の体積比は、
(27.0×2+16.0×3)×1/2 ÷ 3.99 ÷ 27.0/2.70=1.27
Q-12.
第2問 オ
Alの単体は,Al3+を含む水溶液の電気分解では得ることができない。その理由を簡潔に説明せよ。
A-12.
Alのイオン化傾向はHよりも大きいため、水の還元が起こってしまうため。
Q-13.
第2問 カ
Al2O3・3H2OとNaOHの反応の化学反応式を記せ。
A-13.
Al2O3・3H2O + NaOH → 2Na[Al(OH)4]
Q-14.
第2問 キ
錯イオン[Al(H2O)4(OH)2]+のすべての幾何異性体の立体構造を描け。
ただし、H2OとOH-の立体構造は考慮しなくてもよい。
A-14.
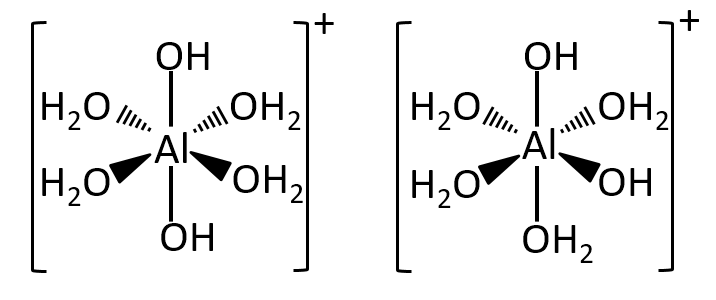
解説
配位子が6個なので正八面体と考えられます。
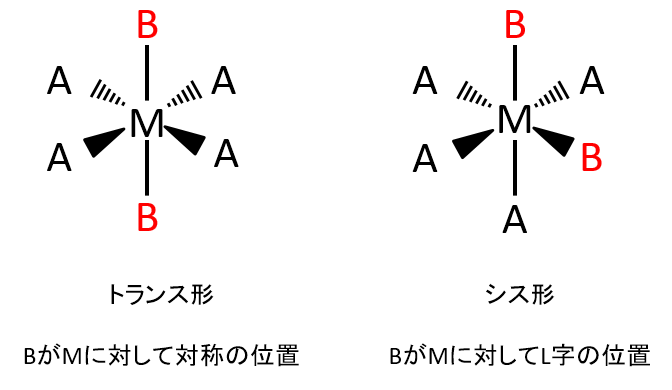
[MA4B2]についてはBの配置の違いにより、下記の2つの異性体があります。Mに対してBが対称の位置にあるものをトランス形、Mに対してBがL字の位置にあるものをシス形といいます。
Q-15.
第2問 ク
陽極、陰極とも炭素を用いたAl2O3の融解塩電解において、陽極でCOとCO2が発生した。
それぞれが発生する際の陽極での反応を電子e-を用いた反応式で示せ。
A-15.
CO: C + O2- → CO +2e-
CO2: C + 2O2- → CO2 + 4e-
----↑ 第2問 ----
----↓ 第3問 ----
第3問は簡単な問題と解答しづらい問題が混合しています。
第3問Ⅰは中和と平衡に関する問題です。中和の過程は問題の設定が複雑なのでよく整理して解答していかないと間違えそうです。
第3問Ⅱは状態、化学反応、熱化学方程式などです。問カの状態変化は、実在気体の分子間力による体積変化を正確に描く必要があります。問コは複雑な設定の熱化学方程式を解いて、反応熱を求めないといけません。
Q-16.
第3問 Ⅱカ
一定圧力のもとで理想気体の温度を下げていくと、その体積はシャルルの法則にしたがって直線的に減少し、絶対温度OKで体積は0になる。横軸を絶対温度、縦軸を体積とした理想気体のグラフを図3-2に破線で示した。一方、実在気体では、臨界点より低く三重点より高い一定圧力のもとで、
温度を下げていくと、分子間力のために温度T1で凝縮して液体になる。さらに温度を下げて温度T2に達すると、凝固し固体になる。図3-2を描き写し、絶対温度に対する実在気体およびその液体と固体の体積の変化を示すグラフを、理想気体との違いがわかるように同じ図の中に実線で描け。
A-16.
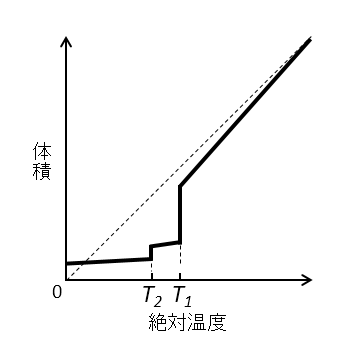
解説
T1より高温では気体です。気体の状態から温度を下げていったときの状態を考えます。
温度を下げていくと体積は減りますが、理想気体と違い、分子間力がはたらくため体積の減り方は大きくなります。したがって実在気体では、点線の理想気体よりも下になります。
T1で凝縮して液体になるため、体積は大きく減少します。液体状態になった後、温度を下げていくと少しずつ体積は減少します。
T2では固体となるためさらに体積は減少しますが、気体と液体ほどの差はありません。固体になった後、温度を下げていくと、液体の時と同様に体積は減少しますが、液体の時ほどの大きな変化はありません。
Q-17.
第3問 Ⅱキ
Niなどの触媒を使って高温でメタンと水蒸気を反応させることにより, 一酸化炭素と水素が製造されている。この反応をメタンの水蒸気改質反応とよぶ。メタンの水蒸気改質反応を化学反応式で示せ。
A-17.
CH4 + H2O → CO + 3H2
Q-18.
第3問 Ⅱク
一酸化炭素と水素からメタノールを工業的に合成する反応は、以下の式1で表すことができる。
CO(気) + 2H2(気)⇄ CH3OH (気) (式1)
この反応を利用したメタノールの合成が、高圧下で行われる理由を説明せよ。
A-18.
高圧にすると、ルシャトリエの原理により、気体の分子数が減少する右に平衡が偏るのでメタノールが多く生成し、また、高圧ほど反応速度が大きくなるため。
解説
①平衡が右に偏る、②反応速度が速くなる、の2つの項目について述べる必要があります。 本問のリード文では工業的合成について述べられています。工業的には反応速度が速いというのは重要です。
また、ルシャトリエに続く言葉は原理です。「法則」も使われますが、原理の方が一般的のように思います。
----↑ 第3問 ----