東京大学 2017年 化学 一問一答と解説
【問題分析】
2017年の東京大学化学の問題は取り組みやすい問題が多かった印象です。
問題の中には難しいものもありますが、その数は少ないといえます。
第1問の有機化学の問題は炭素の数が4個の分子量の小さい化合物でしたので、構造の決定も容易だと思います。
第2問 Ⅰの金属イオンの分離の問題では、H2Sを通じた後の3段階の操作を答える問題が出題されました。
H2Sを通じることにより、Fe2+になってしまったものをFe3+に戻し、
さらに過剰のアンモニア水を加えてZn2+以外を沈殿させる操作ですが、なんとなく覚えているだけでは
自信をもって解答できないのではないかと思います。
第2問 Ⅱでは硫酸の不揮発性を利用する反応に関して、なぜ濃塩酸を使用しないのかを答える問題がありました。
単に化学反応式を覚えるだけではなく、理由も併せて理解しておく勉強が必要です。
第3問 Ⅰは鉛蓄電池の問題でした。
鉛蓄電池の正極、負極の反応を答えるストレートな問題がありました。
また、鉛蓄電池で定番の電極の重量変化に関する問題もありました。電極と電解液の重量変化を正確に書き下し、
グラフから数値を読み取って移動した電子のモル数を求める必要があります。
第3問 Ⅱの平衡の問題は基本事項が理解できているかどうかを試す良い問題です。
気体の状態や平衡に関してしっかり理解できていたら、確実に解答できる問題です。
【一問一答】
----↓ 第1問 ----
【解答上のポイント】
第1問は有機化合物の構造決定の問題です。
分子量が小さいので非常に解答しやすいと思います。
問アは有機化合物を燃焼させて、発生した二酸化炭素と水を吸収させる化合物を答える問題です。
問題演習では何度も見たことがあると思います。
Q-01.
問ア
有機化合物を完全に燃焼させ、生じた物質を( a )の入ったU字管と( b )の入ったU字管へ
通したところ、それぞれ27.0 mgの水と88.0 mgの二酸化炭素が吸収されていることがわかった。
( a )、( b )に当てはまる最も適切な化合物名をそれぞれ記せ。
A-01.
a 塩化カルシウム
b ソーダ石灰
Q-02.
第1問 イ
有機化合物Aの分子量は86.0で、炭素、水素、酸素からなる。
43.0 mgのAを完全燃焼させると、27.0 mgの水と88.0 mgの二酸化炭素が生じた。
化合物Aの分子式を示せ。
A-02.
C4H6O2
解説
解法1 43.0 mg中のC, H, Oの重量の内訳を求めて物質量比を求める方法
C: \(\displaystyle 88.0 \times \frac{12}{44}=24\) mg
H: \(\displaystyle 27.0 \times \frac{2}{18}=3\) mg
O: \(\displaystyle 43.0-24-3=16\) mg
C, H, Oの物質量比は \(\displaystyle \frac{24}{12} : \frac{3}{1} : \frac{16}{16}=2: 3: 1\)
C2H3O=43
分子量は86.0のため、Aの分子式はC4H6O2
解法2 C, H, Oの物質量比を一気に求める式を立てて計算する方法
この問題の場合、化合物Aの分子量が86.0と与えられているので、この方法が使えます。
例えば、化合物Aの分子量が○○~□□という条件で与えられているときは、この方法は使えないので、解法1の方法で計算します。
C: \(\displaystyle \frac{88.0 \times 10^{-3}}{44} \times \frac{86.0}{ 43.0 \times 10^{-3} }=4 \)
1つ目の分数は、88.0 mg中にCが何モルあるかを計算する式です。
2つ目の分数は、43.0 mgを何倍すれば、化合物A 1 mol (=86.0 g)になるかを計算する式です。
Hも同様に、
H: \(\displaystyle \frac{27.0 \times 10^{-3}}{18} \times 2 \times \frac{86.0}{ 43.0 \times 10^{-3} }=6 \)
Oの物質量は化合物A 1molで計算していきます。
O: \(\displaystyle \frac{86.0-12.0 \times 4-1.0 \times 6 }{16}=2 \)
したがって、 C : H : O = 4: 6: 2
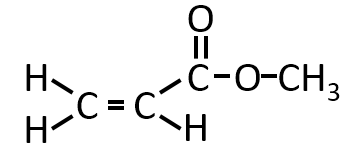
Q-03.
問ウ
有機化合物Bは分子式がC4H6O2で、炭素-炭素二重結合を一つもつエステルである。
Bを加水分解して得られた生成物の一つは、三つの炭素原子をもつカルボン酸であった。
Bの構造式を示せ。
A-03.
Q-04.
問エ
有機化合物Dは分子式がC4H6O2で、カルボキシ基をもつ。
化合物Dの構造式として考えられるものをすべて示せ。
A-04.
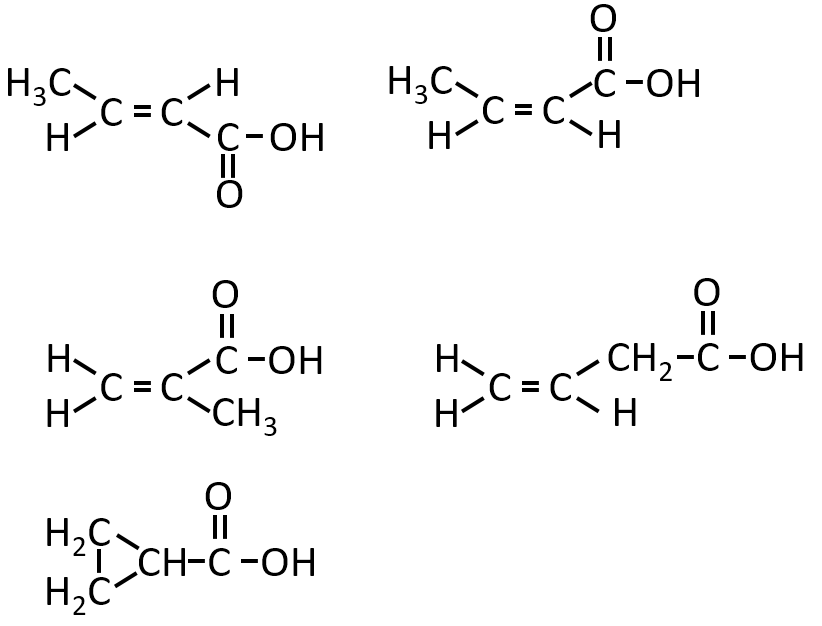
Q-05.
問カ
アクリロニトリルと酢酸ビニルを物質量比2:1で混合したのち付加重合すると完全に反応が進行し、高分子化合物Cが得られた。
Cの平均分子量は9.60×104であった。高分子化合物Cの一分子あたりに平均して含まれる窒素原子の数を有効数字2桁で答えよ。
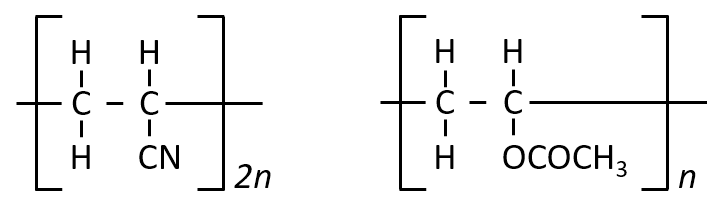
A-05.
1.0×103
解説
53.0×2n + 86.0n = 9.60×104
2n = 1.00×103
Q-06.
問キ
下記の化合物の付加重合により得られた高分子化合物の一部を架橋し、エステル結合を加水分解したものは、水を吸収・保持する性質を示した。
吸収した水を保持する理由を簡単に説明せよ。

A-06.
高分子に含まれる-COO-と水分子が水素結合を形成するため。
解説
「水素結合」というキーワードは必ず入れる。
【解答上のポイント】
Ⅰは非常にイオンの反応、沈殿、分離に関する基本的な問題です。
高得点を取りたいところです。
Q-07.
Ⅰ問ア(1)
試薬、熱、電気を使うことなく、AgClからAgへと還元する方法を答えよ。
A-07.
光を当てる。
解説
AgClに光を当てるとAgが遊離する。
Q-08.
Ⅰ問ア(2)
還元性を持つ脂肪酸を答えよ。
A-08.
ギ酸
解説
アンモニア性硝酸銀と反応して銀鏡反応を示す。
Q-9.
Ⅰ問イ
リチウムの炎色反応の色を答えよ。
A-9.
赤色
Q-10.
Ⅱ問カ
窒素が最大の酸化数をとる窒素化合物と、最小の酸化数をとる窒素化合物の化学式を、
それぞれの窒素の酸化数とともに答えよ。
A-10.
最大: HNO3、酸化数 +5
最小: NH3、酸化数 -3
Q-11.
Ⅱ問キ
NO2と水分が反応して硝酸が生成する化学反応式を示せ。
A-11.
温水の時: 3NO2 + H2O → 2HNO3 + NO
冷水の時: 2NO2 + H2O → HNO3 + HNO2
(HNO2は亜硝酸)
解説
予備校などは、水温が高い時の
3NO2 + H2O → 2HNO3 + NO
を答えとしていました。
高校で習うのが上記の反応であり、また次の問題とのつながりもあるためです。
Q-12.
Ⅱ問ケ
硝酸カリウムに濃硫酸を加えて硝酸ができる化学反応式を示せ。
また、濃塩酸を使わない理由を簡潔に説明せよ。
A-12.
KNO3 + H2SO4 → KHSO4 + HNO3
理由:この反応は濃硫酸の不揮発性を利用した反応であるが、濃塩酸は揮発性であるから。
解説
揮発性酸遊離反応。
濃硫酸を利用して、揮発性の酸を追い出す反応です。
この問題は次の反応の応用です。次の反応は少なくとも覚えておく必要があります。
NaCl + H2SO4 → HCl + NaHSO4
KNO3 + H2SO4 → KHSO4 + HNO3の反応で濃硫酸の代わりに濃塩酸を使うと、HClが蒸発して出てくる。
----↑ 第2問 ----
----↓ 第3問 ----
【解答上のポイント】
Ⅰは鉛蓄電池などの電気化学の問題です。
Ⅱは気体の平衡の問題です。
いずれも基本的な問題が多いため、高得点を取りたいところです。
Q-13.
Ⅰ問カ
鉛蓄電池の放電時に、正極および負極で起こる変化を、それぞれ電子e-を用いたイオン反応で示せ。
A-13.
正極 PbO2 + 4H+ + SO42- + 2e- → PbSO4 + 2H2O
負極 Pb + SO42- → PbSO4 + 2e-
解説
鉛蓄電池の反応では、正極負極の反応とも、左辺にSO42-を入れる。
鉛蓄電池の反応式は非常に基本的な項目です。東京大学でなくても出題されます。
Ⅱは一問一答の題材がないため省略します。
----↑ 第3問 ----