2021年 奈良女子大学 化学 一問一答と解説
【問題分析】
奈良女子大学2021年化学の問題は基本に沿った問題がほとんどです。教科書と標準的な問題集で十分対応可能です。基本事項を確実に学習していれば、高得点がとれます。 ?
今年の問題で唯一標準から外れていたのは、問題Ⅲの問1のエチレンを酸化してアセトアルデヒドを生成する反応です。これはワッカ―酸化とよばれるもので、あまり見たことはないと思います。
2021年の奈良女子大学の化学の入試問題から一問一答を作ってみました。
【一問一答】
----↓ 問題Ⅰ ----
【解答上のポイント】
問題1は無機化学系の混合問題です。
問題としては基本的な内容です。標準的な問題集で勉強しておけば答えられる問題です。
Q-01.
問2
塩素分子には2つの塩素原子の質量数の和が70、72、74の3つのものが存在する。その存在比を9 : 6 : 1とし、相対質量と質量数が等しいものとして塩素の原子量を有効数字3桁で求めよ。
A-01.
35.5
解説
存在比から原子量を求める問題はよくありますが、この問題は問題の設定上、少し難しくなっています。
大学発表の解答では、「質量数の和が70、72、74 となるので、塩素原子の質量数は35 か37 のいずれか」と書いてありますが、塩素分子の質量数が72であれば塩素原子の質量数が36と36の組み合わせも考えられます。
大学の模範解答では、塩素原子の質量数は35か37のいずれか、としているのは、質量数36の塩素原子は天然にはほとんど存在しないためではないかと思われます。
解答するときはこの前提で計算しないと答えが出せません。
計算方法
35Cl の存在割合をx、37Cl の存在割合を (1 - x) とすると
\(\displaystyle x^2= \frac{9}{9+6+1} = \frac{9}{16}\)
よって、x=3/4。
したがって、塩素の原子量は
\(\displaystyle 35 \times \frac{3}{4} +37 \times \frac{1}{4}=35.5\)
計算方法別解
この問題は、塩素分子の平均分子量を求め、その半分を原子量として計算する方が簡単です。
\(\displaystyle \frac{9 \times 70 + 6 \times 72 +1 \times 74}{16} =71\)
よって、塩素の原子量は35.5。
Q-02.
問3
下記のイオンをイオン半径の小さいものから順に並べよ。また、理由を述べよ。
O2-、F-、Na+、Mg2+
A-02.
Mg2+ < Na+ < F- < O2-
すべて閉殻でNeと同一の電子配置を持っていているため、原子核の電荷が小さくなるほど(原子番号が小さくなるほど)イオン半径は大きくなる。
Q-03.
問4
過酸化水素、二酸化炭素、シアン化水素、硫化水素の分子について電子式を書け。
A-03.
過酸化水素
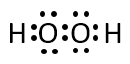
二酸化炭素
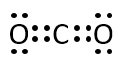
シアン化水素
![]()
硫化水素
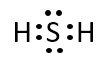
Q-04.
問5
過酸化水素が酸化剤、還元剤としてはたらくときの反応を表す半反応式をそれぞれ答えよ。
A-04.
酸化剤: H2O2 + 2e- + 2H+ → 2H2O
還元剤: H2O2 → O2 + 2e- + 2H+
解説
非常に基本的な問題なので、答えられるようにしておきたいです。
過酸化水素は、相手によって酸化剤としても還元剤としてもはたらくことは覚えておかなければなりません。
酸化剤、還元剤両方のはたらきをするものは他には二酸化硫黄(SO2)があります。
Q-05.
問6
過マンガン酸イオンが酸性水溶液中において酸化剤としてはたらくときの反応を表す半反応式をそれぞれ答えよ。
A-05.
MnO4- + 5e- + 8H+ → Mn2+ + 4H2O
解説
非常に基本的な問題なので、答えられるようにしておきたいです。
Q-06.
問7
過マンガン酸カリウム水溶液の色を答えよ。
A-06.
赤紫色
----↓ 問題Ⅱ ----
問題2は反応速度や平衡に関する問題です。
こちらの問題も標準的なレベルです。
大学発表の解答で気になったのは、問2の熱化学方程式を書く問題です。
大学発表の解答では、H2 + I2 = 2HI + 9kJ となっていますが、熱化学方程式では基本的には物質の状態を書かないといけません。
正しくは下記のように書くのが良いです。
H2(気) + I2(気) = 2HI(気) + 9kJ
問題Ⅱは一問一答の題材がないので出題は省略します。
----↓ 問題Ⅲ ----
問題Ⅲは有機化学の問題です。
問1を除き、標準的な問題です。
問1ではエチレンを酸化してアセトアルデヒドを生成する内容が出題されています。これはワッカ―酸化とよばれるものです。
この問題が全問題を通して一番難しかったと思います。
2022年 共通テスト 第2日程(1月30日・31日)第4問 問1でも出題されています。しかし、かなり注意深くこの問題に取り組んでいないと、覚えていないと思います。
Q-07.
問1
塩化パラジウム(Ⅱ)と塩化銅(Ⅱ)を触媒として、エチレンを酸素で酸化するとアセトアルデヒドが生成する。
正しいか誤りか答えよ。
A-07.
正しい。
解説
ワッカ―酸化という反応です。
記載の通りの触媒を用いれば、エチレンからアセトアルデヒドが生成します。
Q-08.
問1
アセチレンを赤熱した鉄に触れさせるとなにが生成するか答えよ。
A-08.
ベンゼン
解説
これは覚えておかなければならない問題です。
Q-09.
問2
160~170℃に熱した濃硫酸にエタノールを加えるとエチレンが合成できる。130~140℃程度で反応を行ったときに生成する化合物の構造式を書け。
A-09.
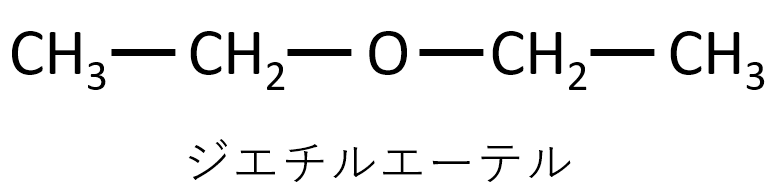
解説
反応させるときの温度がポイントです。低温だとジエチルエーテルが生成します。
Q-10.
問3
炭化カルシウムからアセチレンを合成する反応式を記せ。
A-10.
CaC2 + 2H2O → H-C≡C-H +Ca(OH)2
解説
まず炭化カルシウムがCaC2 と書けるかどうかです。
次に、反応に水を使い、CaOではなく、Ca(OH)2ができると知っているかどうかです。
Q-11.
問8
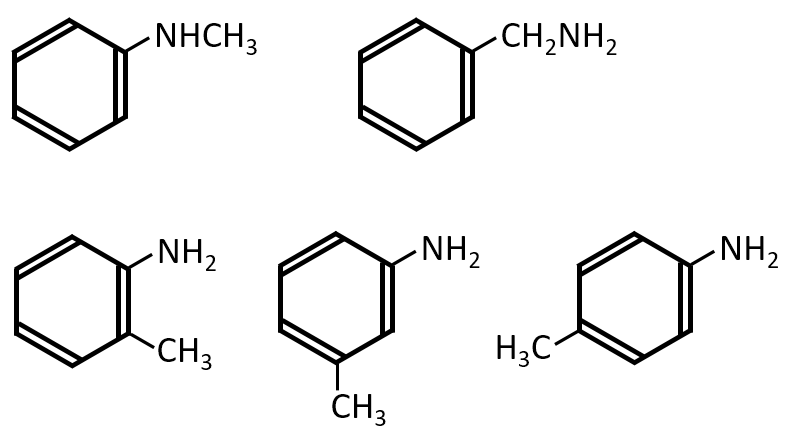
分子式がC7H9Nである化合物のうち、ベンゼン環を有する化合物は何種類存在するか。
A-11.
5種類
解説
C7H9Nからベンゼン環のC6個を引くとCが1個とNが1個残ります。このC1個とN1個のベンゼン環への付き方で異性体ができます。
ベンゼン環に対して、C-NまたはN-Cの官能基が1つ付く場合と、NH2とCH3の二置換体となる場合があります。二置換体ではオルト、メタ、パラ位の3つがあります。