2022年 名古屋大学 化学 一問一答と解説
2022年の名古屋大学の入試問題から一問一答を作ってみました。【一問一答】
----↓ 問題Ⅰ----
【解答上のポイント】
問題Ⅰ 問1は反応速度の問題でした。
昨年に引き続き、物理のように数式を答えていく問題でした。
ほとんどの問題は丁寧にやっていけば解答できる問題です。
設問(2)は与えられたデータから反応速度の実際の数値を求める問題でした。誘導がなかったため、計算方法が分からなかったかもしれません。
通常このタイプの問題は誘導がついていますが、名古屋大学の問題は誘導無しで解答しなければなりませんでした。
数値を解答する問題はこの問題だけでした。設問(3)も数値ではなく数式で答える問題でした。この辺り、数値か数式かを間違わないようにしないと、解答方法が分からずに考え込んでしまうかもしれません。
問題Ⅰ 問2は緩衝液の問題でした。弱酸の初期濃度と電離定数からpHを求める、などの問題でした。
このタイプの問題は計算するときに濃度で計算していくことに留意しなければなりません。
設問(2)のように混合後に酸の濃度が変わるような場合は、計算するときに注意が必要です。
Q-01.
問1 設問(2)
次の、物質X(気体)から、物質Y(気体)と物質Z(気体)が生成する反応を考える。
2X → 4Y + Z
Xの分解速度v [mol/(L・min)]は、Xの濃度[X] (mol/L)と反応速度定数kを用いて、
\(\displaystyle v= -\frac{ d[X] }{ dt }=k[X] (1)\)
と表されるとする。
Xの分解反応における時間tと濃度[X]の関係が下の表のとき、kの値を有効数字2桁で求め、単位を含めた形で答えよ。
| t 〔min〕 | \(0.00\) | \(10.00\) | \(20.00\) |
| [X] 〔mol/L〕 | \(5.30 \times 10^{-3}\) | \(4.00 \times 10^{-3}\) | \(3.01 \times 10^{-3}\) |
A-01.
\(2.8 \times 10^{-2}\) min-1
解説
\(\displaystyle -\frac{ d[X] }{ dt }\)は濃度の時間変化なので、0から10分の間の傾きとします。
\(\displaystyle -\frac{ d[X] }{ dt }= -\frac{ 4.00 \times 10^{-3}-5.30 \times 10^{-3}}{10.0-0.00}\)
ここで左辺の\(k[X]\)における\([X]\)の値をどうするかですが、これは0から10分の間の平均値とします。
\(\displaystyle [X]=\frac{5.30 \times 10^{-3}+4.00 \times 10^{-3}}{2}\)
これを式(1)に代入してkを求めます。
ちなみに表のデータをグラフ化すると下の図になります。●は表の値をプロットした点、点線は図中に示した指数関数で表される曲線です。
3つの点は直線上にあるように見えますが、そうではありません。
本問題では反応速度定数の値を計算するとき、\(\displaystyle -\frac{ d[X] }{ dt }\)は2点間の傾きとしましたが、正確にはある点における接線です。その時の濃度[X]を用いて反応速度定数kが計算されます。
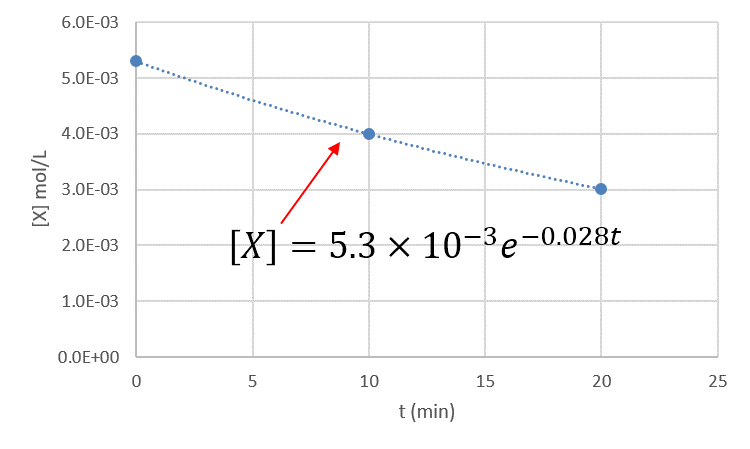
「答え」のところでは0~10分の間で計算しましたが、10~20分で計算しても同じ結果になります。
0~10分の傾きは、10~20分の傾きよりも大きいですが、平均値も0~10分間の方が高くなるため、反応速度を計算するとほぼ同じ値になります。
Q-02.
問2 設問(3)
以下の6つの塩のうち、その水溶液が酸性になるものをすべて選び、化学式で答えよ
硫酸水素ナトリウム、炭酸ナトリウム、硫酸ナトリウム、炭酸水素ナトリウム、塩化ナトリウム、塩化アンモニウム
A-02.
NaHSO4, NH4Cl
----↓ 問題Ⅱ----
問題Ⅱ 問1は無機化学系のよくある問題です。語句を答える問題は簡単ですが、設問(2)の計算問題は数値の計算が非常に困難な問題です。
やはり化学は筆算が速い人は有利だと思います。
問題Ⅱ 問2は電池や酸化還元の問題です。語句の補充も計算も非常に簡単な問題です。
問2は確実に得点したい問題です。
Q-03.
問1 設問(1)
次の文中の[ア]~[カ]にあてはまる最も適当な物質名を記せ。ただし、空欄[イ]、[ウ]については
括弧内の語句のいずれかを選択せよ。
常温常圧において,周期表で同じ14族に属する単体のケイ素Siや,炭素とケイ素のみからなる化合物である
[ア]にも,炭素の同素体のひとつであるダイヤモンドと同様な結晶構造をもつものがある。同様な結晶構造の物質間で
比較すると,ダイヤモンド, [ア], ケイ素の順に,電気伝導性は[ イ(増加・減少)]し,硬度は[ウ(高く,低く)]なる。
けい砂を水酸化ナトリウム水溶液と混ぜて圧力容器中で加熱すると,粘度の高い溶液である[エ]が得られる。[エ]には,ナトリウムイオン,
水酸化物イオンのほかに.ケイ素と酸素を含む分子量の大きいイオンが溶解している。この溶液に塩酸を加えると,白色の固体である[オ]
が析出する。[オ]に含まれる水溶性の成分を洗浄・除去して乾燥させた固体は[カ]と呼ばれる。[カ]は分子の大きさ程度の微細な空間を
多数含み,明確な結晶構造をもたない非晶質である。
A-03.
常温常圧において,周期表で同じ14族に属する単体のケイ素Siや,炭素とケイ素のみからなる化合物である
[ア 炭化ケイ素]にも,炭素の同素体のひとつであるダイヤモンドと
同様な結晶構造をもつものがある。同様な結晶構造の物質間で比較すると,ダイヤモンド, [ア 炭化ケイ素], ケイ素の順に,電気伝導性は[イ 増加]し,硬度は[ウ 低く]なる。
けい砂を水酸化ナトリウム水溶液と混ぜて圧力容器中で加熱すると,粘度の高い溶液である[エ 水ガラス]が得られる。[エ 水ガラス]には,ナトリウムイオン,水酸化物イオンのほかに.ケイ素と酸素を含む分子量の大きいイオンが溶解している。この溶液に塩酸を加えると,白色の固体である[オ ケイ酸]が析出する。[オ ケイ酸]に含まれる水溶性の成分を洗浄・除去して乾燥させた固体は[カ]と呼ばれる。[カ シリカゲル]は分子の大きさ程度の微細な空間を多数含み,明確な結晶構造をもたない非晶質である。
解説
[エ]以降の後半部分は水ガラスからシリカゲルへの変化に関する頻出問題です。
[エ」は出題の意図として、濃度の高いケイ酸ナトリウムを特に何というかを問うていると考えられるため、「ケイ酸ナトリウム」と答えるのは不適当と考えられます。
Q-04.
問1 設問(5)
水ガラスを塩酸で中和してケイ酸が生じる化学反応式を記せ。ただし、水ガラスの組成式をNa2SiO3とせよ。
A-04.
Na2SiO3 + 2HCl → H2SiO3 + 2NaCl
解説
最後の設問で非常に簡単な問題が出題されています。全体をよく見てこのような簡単な問題から解答したいところです。
Q-05.
問2 設問(1)
下記の文中の[ウ]には括弧内のいずれかを、[エ]には化学式を記せ。
マグネシウムは[ウ(冷水・熱水)]や弱酸性の水溶液と反応し、気体である[エ]を発生する。
A-05.
マグネシウムは[ウ 熱水]や弱酸性の水溶液と反応し、
気体である[エ H2]を発生する。
解説
[ウ]は選択肢が与えられていましたが、選択肢なしでも解答できるようにしたいところです。
Q-06.
問2 設問(1)
下図に示す電池を考える。この電池に海水や食塩水などを電解質水溶液として注入すると、正極ではO2の還元反応
により水酸化物イオンが生じ、負極ではマグネシウムの酸化反応によりマグネシウムイオンが生じる。
電池全体の化学反応式を示せ。
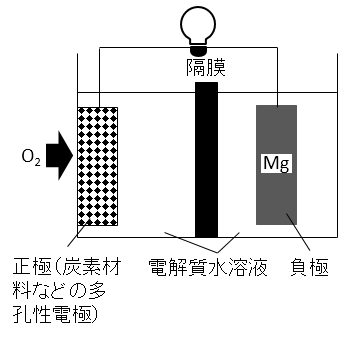
A-06.
2Mg + O2 + 2H2O → 2Mg(OH)2
解説
問題文では「マグネシウムイオンが生じ」と書いてありますが、電池全体の反応としては、イオンを含まない形で書く必要があります。
----↓ 問題Ⅲ----
問題Ⅲ 問1は有機化学、問2はアミノ酸やペプチドの問題でした。
問1の有機化学の問題は高校生では見たことがないような化合物を題材にしたものでした。
問2のペプチドの問題は問題集などによくあるタイプのものでしたが、ペプチドの分子量が大きく、構成要素のアミノ酸を求める問題は解答に時間がかかりそうな問題でした。
Q-07.
問1 設問(5)
化合物Dの分子式はC8H8である。化合物Dは不飽和結合をもたず、すべてのC-C結合の長さは等しい。また、どの水素原子1個を塩素原子に置き換えても、あるいはどの炭素原子1個をケイ素原子に置き換えても、それぞれ1種類の化合物となる。Dの構造式を記せ。
A-07.
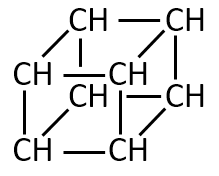
このような構造だとC8H8の分子式で不飽和結合をもたない化合物となります。
解説
答えの化合物はキュバンと呼ばれる化合物です。高校生で知っている人は少ないと思います。
Q-08.
問2 設問(1)
イオン交換樹脂のうち、スルホ基などの酸性の官能基が導入された樹脂を陽イオン交換樹脂という。
陽イオン交換樹脂をカラムに詰め、塩化ナトリウム水溶液を通すと、流出する水溶液は酸性を示す。
流出する水溶液が酸性を示す理由を説明せよ。
A-08.
樹脂中のスルホ基のH+と、水溶液中のNa+が交換され、流出後にHClが含まれるから。
Q-09.
問2 設問(2)
実験1: ペプチドXの水溶液に薄い水酸化ナトリウム水溶液を加えた後、薄い硫酸銅(Ⅱ)CuSO4水浴液を加えると、
赤紫色を呈した。
実験1からペプチドXの構造についてわかることを簡潔に説明せよ。
A-09.
2個以上のペプチド結合をもつ。
(3個以上のアミノ酸からなる)
解説
ビウレット反応です。
Q-10.
問2 設問(3)
ベプチドXは不斉炭素原子を3個もち、環状構造をもたないことがわかった。ペプチドXに十分量の無水酢酸を反応させると
分子量が84増加し、続いて酸触媒を用いてメタノールを作用させると、分子量がさらに14増加し、
分子式C19H34N4O6で表される化合物が生じた。
ペプチドXの分子式を記せ。
A-10.
C14H28N4O4
解説
無水酢酸はCH3CO-O-COCH3であり、ペプチドの-NH2と次のように反応します。
-NH2 + -COCH3 → -NH-CO-CH3 + H
すなわち-COCH3が1個付加して、Hが1個取れます。
-COCH3の分子量は43のため、上記の反応が起こるとペプチドの分子量は43 - 1 = 42 増えます。
無水酢酸と反応して分子量が84増えているため、-COCH3が2個付加しています。
メタノールはCH3OHであり、ペプチドの-COOHと次のように反応します。
-COOH + CH3OH → -COOCH3 + H2O
CH3OHの分子量は32のため、上記の反応が起こるとペプチドの分子量は32 - 18 = 14 増えます。
メタノールと反応して分子量が14増えているため、CH3OHが1個付加しています。
したがって、アミノ酸Xの分子式をxとすると
x + ( COCH3 - H )× 2 + ( CH3OH - H2O ) = C19H34N4O6
x = C19H34N4O6 - ( COCH3 - H ) × 2 - ( CH3OH - H2O ) = C14H28N4O4
となります。