2020年 名古屋大学 化学 一問一答と解説
【問題分析】
2020年は簡単な問題が多いため、スピード勝負のような感じです。
いかに速く正確にどれだけ数多く解答できるかで順位が決まりそうな問題です。
2020年の名古屋大学の化学の入試問題から一問一答を作ってみました。
【解答上のポイント】
問題Ⅰは原子や結晶構造に関する問題でした。
知識問題は基本的なものですので、確実に解答したいレベルです。
結晶構造は図に最近接原子のヒントが描かれているので見落とさないようにして解答したいところです。
モルの定義に関する正誤問題は分かりにくかったかもしれません。
【一問一答】
Q-01.
設問(1)ア
ケイ素Siは地殻中で何番目に多い元素か答えよ。
A-01.
2番目
解説
地殻中に多い元素を順番に並べると、下記のようになります。
O, Si, Al, Fe, Ca, Na
語呂 おっしゃるてかな
Q-02.
設問(1)イ
ケイ素Siは天然では単体として存在せず多くはケイ酸塩や「イ」として岩石中に存在している。「イ」を化学式で答えよ。
A-02.
SiO2
解説
何とも分かりにくい設問です。
ケイ素の存在形態として設問の直前では「ケイ酸塩」と化合物名を書いてあるのに、解答は化学式で答えます。
Q-03.
設問(1)ウ
Siの結晶構造において、単位格子の中にSi原子は何個含まれているか答えよ。
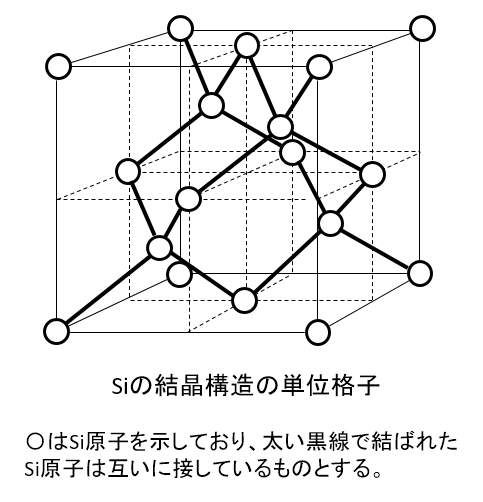
A-03.
8個
解説
単位格子の中に完全に入っている原子が4個ある。
1/8含まれているものが8個、1/2含まれているものが6個で、合計8個
類似の問題で2016年 東京大学 第2問にはダイヤモンドの結晶構造の出題あり
Q-04.
設問(1)エ
ケイ素Siの電気伝導性は金属と絶縁体の中間であるためどのような性質を示すか答えよ。
A-04.
半導体の性質
Q-05.
設問(1)エ
SiO2と炭酸ナトリウムNa2CO3を混ぜて加熱するとケイ酸ナトリウムNa2SiO3が生じる。この反応について化学反応式を書け。
A-05.
SiO2 + Na2CO3 → Na2SiO3 + CO2
----↓ 問題Ⅱ----
【解答上のポイント】
問1は無機化学と熱化学方程式の基本的な問題です。
問2は反応速度を微分積分で扱った問題です。基本に沿って解答していけばできるような誘導の設定になっていますが、少しわかりにくいところもあります。考えているとどんどん時間が経ってしまうので後回しにしてもいい問題かもしれません。
誘導の最後まで無事にたどり着くことができると、筆算の計算問題が待っています。この筆算の計算は本当にあっているのかな?と思うような計算式になります。有効桁数も1桁で答えることになっています。
【一問一答】
Q-06.
問1 設問(1)
KClO3、Cl2、KClの塩素原子Clの酸化数をそれぞれ求めよ。
A-06.
KClO3: +5
Cl2: 0
KCl: -1
Q-07.
問1 設問(2)
加熱した水酸化カリウムKOH水溶液に塩素Cl2ガスを吹き込むとKClO3が生成する。同時に塩化カリウムKClと水H2Oも生成する。
この反応を化学反応式で記せ。
A-07.
3Cl2 + 6KOH → KClO3 + 5KCl + 3H2O
Q-08.
問2 設問(1)ア
M+ + L ⇄ ML+ (Ⅲ)
M+、 LおよびML+の濃度を,[M+]t〔mol/L〕,[L]t〔mol/L〕および[ML+]t〔mol/L〕と定める。
さらに、(Ⅲ)式の正反応の速度は[M+]tと[L]tに比例し、逆反応の速度は[ML+]tに比例すると仮定する。絶対温度Tにおける正反応と逆反応の速度定数をそれぞれk1〔L/(mol・s)〕およびk-1〔/s〕とする。この反応系の絶対温度がT[K]のとき、見かけの右向きの反応速度-d[M+]t/dt [mol/(L・s)]をk1、 k-1、 [M+]t、[L]t および[ML+]tを用いて表せ。
A-08.
\(\displaystyle \frac{ -d[M^+]_t }{ dt }=\)k1[M+]t[L]t - k-1[ML+]t
解説
可逆反応では、常に右向きと左向きの反応が起こっています。
右向きの見かけの反応速度なので、(右向きの反応速度)―(左向きの反応速度)になります。
----↓ 問題Ⅲ----
【解答上のポイント】
問題Ⅲは、理論化学、無機化学系の混合問題です。
初めは、電離定数や溶解度積に関する問題です。溶解度積で沈殿するかどうか判断する典型的な問題です。
次に、金属イオンの混合物溶液から、沈殿を作る問題です。
その次は電気分解の問題でした。
ほとんど標準的な問題ですので、ミスをしないように確実に点数を取りたい問題です。
【一問一答】
Q-09.
設問(2)
H2Sは水溶液中で次のように2段階で電離する。
H2S ⇄ H+ + HS- (Ⅰ)
HS- ⇄ H+ + S2- (Ⅱ)
ここで,(Ⅰ)式および(Ⅱ)式の電離定数はそれぞれK1、K2である。
(Ⅰ)式および(Ⅱ)式の反応を組み合わせると
H2S ⇄ 2H+ + S2- (Ⅲ)
となり(Ⅲ)式の電離定数Kは、 K1およびK2を用いて
K=「ア」
と表される。
「ア」にあてはまる式を答えよ。
A-09.
K1K2
Q-10.
設問(3)
4種類の金属イオンCu2+、 Ba2+、 Fe3+、 Mn2+を含む水溶液(試料溶液)に対して、次の操作1~3を順に行った。
操作1: 試料溶液に希塩酸を加えて酸性とした後、 H2Sを通じ、生じた沈殿Aをろ過した。
操作2: 操作1のろ液を煮沸してH2Sを追い出し、硝酸HNO3を加えて加熱した。この溶液に塩化アンモニウムNH4ClとアンモニアNH3水を加えて弱塩基性にした後、生じた沈殿Bをろ過した。
硝酸HNO3の役割を20字以内で答えよ。
A-10.
Fe2+をFe3+に酸化する役割。 (17文字)
解説
イオンの分析操作における典型的な問題です。
Q-11.
設問(3)
NH4ClとNH3の混合水溶液のように、少量の酸や塩基を加えてもpHがほぼ一定に保たれる溶液を何とよぶか答えよ。
A-11.
緩衝液
解説
漢字に注意といったところでしょうか。
----↓ 問題Ⅳ----
【解答上のポイント】
問題Ⅳは有機化学の構造決定の問題です。問1としてリード文が与えれれていて設問(1)で一度そのリード文の中で構造決定の問題がありますが、設問(3)でリード文とはあまり関係のない新たな構造決定の問題が出るという変な構成になっています。
問2は別の構造決定の問題です。
問題1、2とも一部を除いてそんなに難しい問題ではありませんが、文が長いので時間がかかってしまうかもしれません。
問題1のポイントは、化合物Cが環状構造で、オゾン分解したとき、還元性とヨードホルム反応を示す構造になるために、1個の炭素だけ環からはみ出した構造となっていることに気が付くか、です。
また問題1ではオゾン分解が出題されています。高校では習わないため、出題されるときは通常は丁寧な説明がついていますが、本問ではオゾン分解を知っていることを前提にして問題がつくられています。
知らなければこの問題は解答できませんのでこの機会に覚えましょう。このHPの基本問題のところで扱っています。
問題1 設問(4)はフェノールの知識問題です。紛らわしい選択肢もあり、よく知っていないと正しく選べないのではないでしょうか。該当するものをすべて選ぶ方式のため、さらに難しくなっています。
問題2のポイントは、ジメチルアニリンC6H5N(CH3)2の構造がわかるかどうかです。これがわかれば、高校の教科書に書いてある塩化ベンゼンジアゾニウムとナトリウムフェノキシドからp-フェニルアゾフェノール(p-ヒドロキシアゾベンゼン)のジアゾカップリングの類推で最後の問題に解答することができます。
【一問一答】
Q-12.
問題1 設問(1)ア
エチレンC2H4とエタンC2H6では、どちらの方が炭素原子間の長さが短いか答えよ。
A-12.
エチレンC2H4
Q-13.
問題1 設問(1)イ
アルケンは二重結合の炭素原子に他の原子や原子団が結合し,単結合になる「イ」 反応を起こしやすい。「イ」にあてはまる語句を答えよ。
A-13.
付加
Q-14.
問題1 設問(1)エ、オ
クメン法は、何と何を反応させて、何と何ができるか答えよ
A-14.
ベンゼンとプロピレンを反応させて、フェノールとアセトンができる。
解説
頻出なので必ず覚えておかなければならない。
Q-15.
問題1 設問(4)
フェノールの水溶液に臭素水を加えたときできる化合物とその色を答えよ。
A-15.
2,4,6-トリブロモフェノール
白色
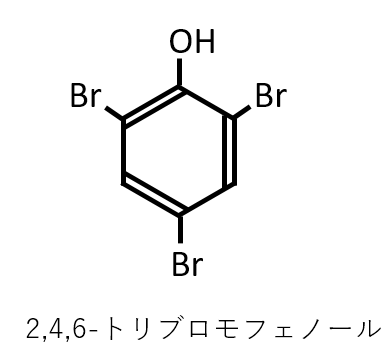
解説
参考: 2,4,6-トリニトロフェノールの色は黄色
Q-16.
問題2 設問(2)
ジメチルアニリンC6H5N(CH3)2の構造式を答えよ。
A-16.
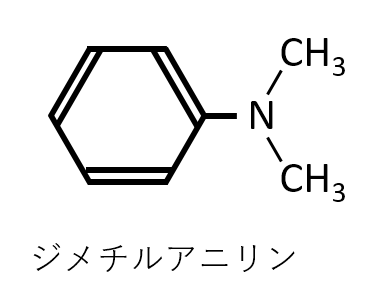
----↓ 問題Ⅴ----
【解答上のポイント】
問題Ⅴは高分子とペプチドの問題です。
ナイロン66を作るために必要な化合物2つを答えるようなストレートな問題など簡単な問題もありますが、計算問題やアミノ酸の構造や異性体の数を答えたりする問題などがあり、少し時間がかかりそうな感じがします。
【一問一答】
Q-17.
設問(1)ア
ナイロン6は、 環状構造の単量体を「ア」重合することにより得られる。
「ア」にあてはまる語句を答えよ。
A-17.
開環
Q-18.
設問(1)イ
ナイロン66やナイロン6は、 分子内に「イ」結合をもつポリ「イ」である。
「イ」にあてはまる語句を答えよ。
A-18.
アミド
Q-19.
設問(1)ウ
下記の構造式で示されるものの化合物名を答えよ。
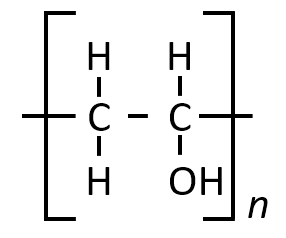
A-19.
ポリビニルアルコール
Q-20.
設問(2)
ナイロン66をつくるための二つの化合物の構造式を示せ。
A-20.
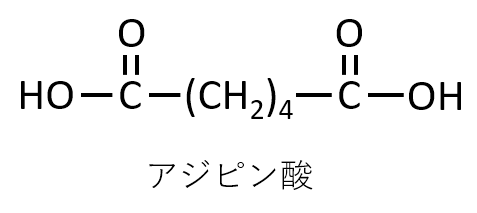
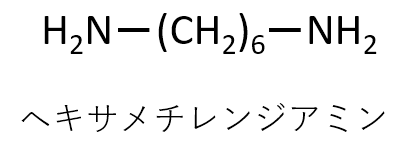
Q-21.
設問(2)
ナイロン6をつくるための化合物の構造式を示せ。
A-21.
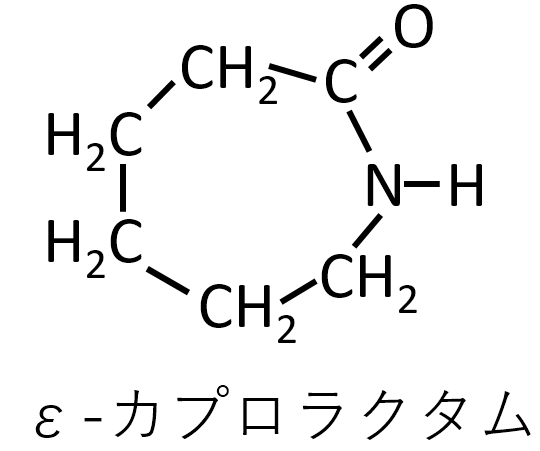
Q-22.
設問(2)
シス形ポリイソプレンの構造式を幾何異性体がわかるように記せ。イソプレンの構造式を下図に示す。ただし,平均重合度をnとする。
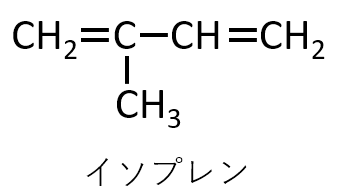
A-22.
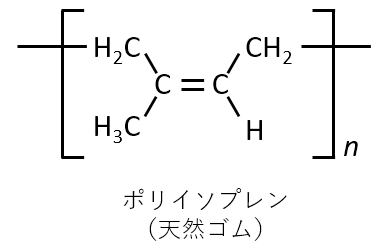
Q-23.
設問(8)
アミノ酸dが1個とアミノ酸eが1個からなるペプチドの構造異性体の数を答えよ。
A-23.
2種類。
解説
d-eとe-dの2種類。
ペプチドの場合、d-eとe-dは同じものではありません。
アミノ酸は-NH2と-COOHが反応して結合ができます。dに着目すると、dが-NH2を結合に使ってできるペプチドと、-COOHを結合に使ってできるペプチドは異なります。
Q-24.
設問(8)
アミノ酸dが2個とアミノ酸eが2個からなる直鎖状のペプチドの構造異性体の数を答えよ。
A-24.
6種類。
解説
d-d-e-e、e-e-d-d、d-e-e-d、e-d-d-e、d-e-d-e、e-d-e-dの6種類。
ペプチドの場合、d-eとe-dは同じものではありません。
アミノ酸は-NH2と-COOHが反応して結合ができます。dに着目すると、dが-NH2を結合に使ってできるペプチドと、-COOHを結合に使ってできるペプチドは異なります。
Q-25.
設問(8)
アミノ酸dが2個とアミノ酸eが2個からなる、枝分れのない環状のペプチドの構造異性体の数を答えよ。
A-25.
下記の2種類。
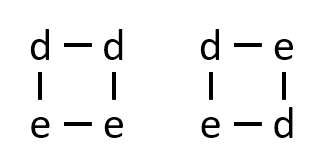
アミノ酸は-NH2と-COOHが反応して結合ができます。dに着目すると、dが-NH2を結合に使ってできるペプチドと、-COOHを結合に使ってできるペプチドは異なります。