3.化学結合と結晶
Q-01.
金属の性質を3つ答えよ
A-01.
・展性(薄く広げられる性質)、延性(引き延ばされる性質)
・電気や熱の良導体
・金属光沢
(化学重要問題集 2021 33)
Q-02.
NaF、 NaCl、 NaBr、NaIを融点の高い順に並べよ
A-02.
NaF > NaCl > NaBr > NaI
イオン半径が大きくなるほどクーロン力は弱くなる。 →融点が低くなる
(化学重要問題集 2021 42)
Q-03.
CaO と NaClはどちらが融点が高いか?
A-03.
CaO
CaO:2572℃、NaCl:801℃
イオンの電荷(価数)が大きく、イオン半径が小さいほどクーロン力は強くなる。
→ 融点が高くなる
(化学重要問題集 2021 42)
Q-04.
MgO とCaOはどちらが融点が高いか?
A-04.
MgO
MgO:2826℃、CaO:2572℃
イオン半径が小さいほどクーロン力は強くなる。
→ 融点が高くなる
(化学重要問題集 2021 42)
Q-05.
MgO、CaO、BaOの結晶のうち、最も融点の高いものを推定し、理由を示せ。
A-05.
MgO
いずれの陽イオンも2価であり、Mg2+のイオン半径が最も小さいため、陽イオンと陰イオンの距離がMgOが最も短いので、クーロン力が最も強く働くため。
(東京大学 2018年 第2問 問ウ)
(化学重要問題集 2021 42)
Q-06.
金属Caと金属Kはどちらが融点が高いか?
A-06.
金属Ca
K: 64℃、Ca: 839 ℃
原子一つ当たりの自由電子が多いほど金属結合は強くなる。
原子一つ当たりCaは自由電子2個、Kは自由電子1個。
(化学重要問題集 2021 42)
Q-07.
Na, K, Rbを融点の高い順に並べよ
A-07.
Na > K > Rb
↑自由電子数が1個で同じで、半径がNa < K < Rbなので、単位体積当たりの自由電子の数はNa > K > Rbとなる。この順に融点が高くなる。
(化学重要問題集 2021 43)
Q-08.
遷移元素の金属と典型元素の金属では、一般的にどちらが融点が高いか?
A-08.
遷移元素
一般に、遷移元素の金属の方が典型元素の金属より融点が高い。
タングステンWは金属結晶のうちでもっとも融点が高い(3410℃)。
(名古屋大学 2021年 問題Ⅱ 設問(6))
(化学重要問題集 2021 42)
Q-09.
HF, HCl, HBr, HIを沸点が高い順に並べよ。(超重要)
A-09.
HF > HI > HBr > HCl
ファンデルワールス力はHI > HBr > HCl > HFだが、HFは水素結合がはたらき、最も分子間力が強くなる。
(化学重要問題集 2021 42)
Q-10.
水素結合を形成する元素を三つ答えよ。(Hの相手になる元素)
A-10.
F, O, N
水素結合
X-H ・・Y- (X、YはF、O、N)
(意味なしリズムで覚える語呂:フォン)
結合の強さは、ファンデルワールス力を1とすると、水素結合が約10、共有結合が約100。
(センター 2015年 基礎 追試 第1問 問5)
Q-11.
HClは水素結合するか。
A-11.
しない。
HClが水素結合しない理由:
塩素の原子半径が大きいため、塩素の表面電荷密度が小さくなる。表面のδ―が弱いので水素原子のδ+を引き付ける力が弱いので水素結合しない。
Q-12.
Q. F, O, N, Cl, Br, Cを電気陰性度の大きい順に並べよ。
A-12.
F > O > Cl > N > Br >C
注:Clは水素結合しない
ハロゲンだけ取り出してみると、F、Cl、Brの順
(センター 2015年 基礎 追試 第1問 問5)
Q-13.
面心立方格子、六方最密充填構造、体心立方格子の結晶構造の形をかけ
A-13.
試験では図が書いてあることが多いが、覚えておいた方が解答しやすいので、かけるようになっておこう。
センター試験では面心立方格子の構造が問われた。
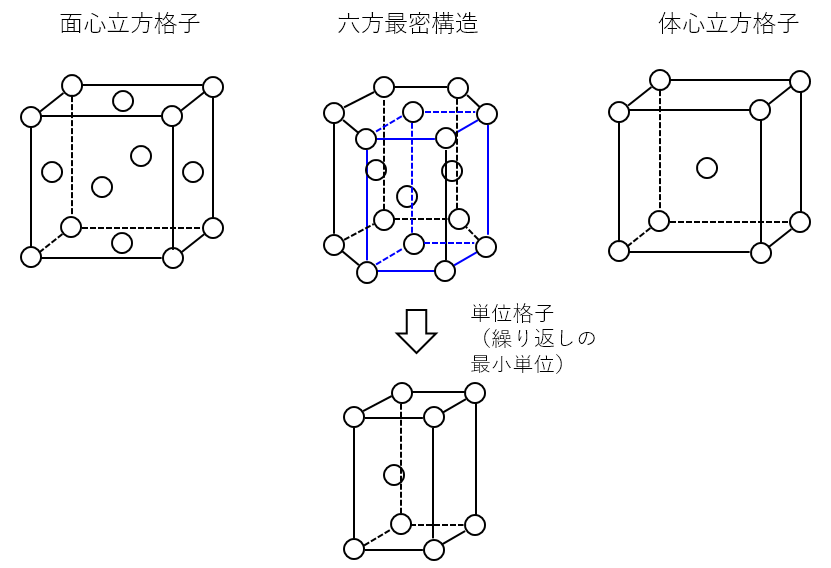
注意:面心立方格子の中央に原子はない。
六方最密構造(「格子」とは言わない)の単位格子(結晶の最小単位)は六角形の柱ではなく、ひし形の柱の部分。
(センター 2016年 第1問 問2)
(化学重要問題集 2021 47)
Q-14.
分子間力とは何か。
A-14.
分子間に作用する引力の総称
・水素結合
・ファンデルワールス力
等がある。
(化学重要問題集 2021 162)