東京大学 2021年 化学 一問一答と解説
2021年の東京大学の入試問題から一問一答を作ってみました。
----↓ 第1問 Ⅰ----
第1問 Ⅰは有機化学の問題です。レベルとしては標準的な問題が多いですが、 問オのHの構造は相当なひらめきがないと解答できないのではないでしょうか。
分子式C6H12Oで表される化合物の異性体には、二重結合を持つものと 環状構造をもつものの2種類があることに注意が必要です。
Q-01.
第1問 Ⅰ
分子式C6H12Oで表される化合物の不飽和度を求めよ。
A-01.
1
解説
不飽和度=\(\displaystyle \frac{2C+2+N-H-X}{2}=\frac{2 \times 6+2-12}{2}=1\)
したがって、二重結合が1つか、環状構造が一つあると推定されます。
Q-02.
第1問 Ⅰ
有機化合物に金属ナトリウムを加えて水素が発生するとき、どのような構造があるか答えよ。
A-02.
-OH
Q-03.
第1問 Ⅰ
アルコール類を酸化して、カルボン酸ができるとき、ケトンができるとき、酸化されないとき、それぞれどのようなアルコールか答えよ。
A-03.
・酸化するとアルデヒドになり、次にカルボン酸になった。 → 第一級アルコール
・酸化するとケトンになった → 第二級アルコール
・酸化されなかった → 第三級アルコール
解説
これは非常に重要なので必ず覚えておかなければならない。
Q-04.
第1問 Ⅰ
ヨードホルム反応を示すのはどのような構造か答えよ。
A-04.
下記の2つの構造です。
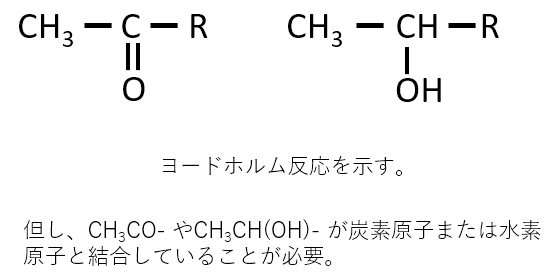
CH3CO- やCH3CH(OH)- が炭素原子または水素原子と結合していないとヨードホルム反応は起きません。
上記の構造式において、Rはアルキル基、アリール基、水素です。
解説
ヨードホルム反応は頻出です。
Q-05.
第1問 Ⅰ
オゾン分解を説明せよ。
A-05.
二重結合の間に酸素が入り、C=O結合をもつ化合物が2つできる。
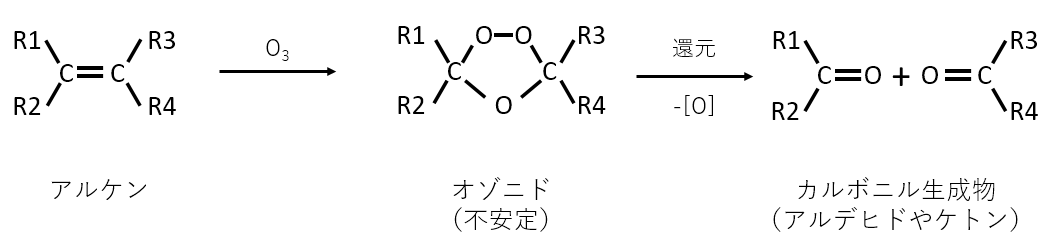
解説
高校の範囲を超えていますが入試化学の定番です。
東京大学に限らずいろいろな大学で出題されています。
ヨードホルム反応と並び定番の反応です。
Q-06.
第1問 Ⅰ ア
分子式がC6H12Oで表される化合物で、五員環を持つが、-OH、C=O結合をもたないものすべての構造式を示せ。また不斉炭素原子に*をつけよ。
A-06.
下記の9種類。
実際の問題では、本問題の条件に加えて、不斉炭素原子が1つのものを答える問題でした。五員環はすべて炭素のものと酸素が入っているものの2種類が考えられます。
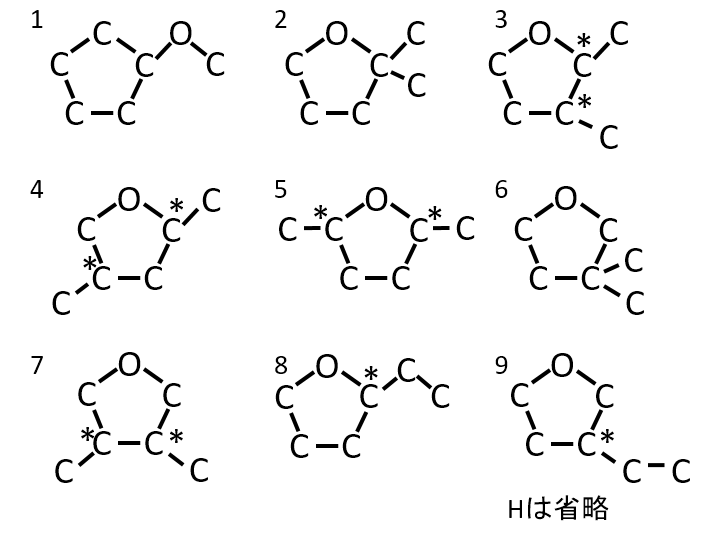
Q-07.
第1問 Ⅰ イ
分子式がC6H12Oで表される化合物で、四員環、-OHを持ち、
ヨードホルム反応を示すものの構造式を示せ。また不斉炭素原子に*をつけよ。
A-07.
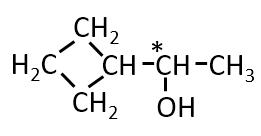
Q-08.
第1問 Ⅰ ウ
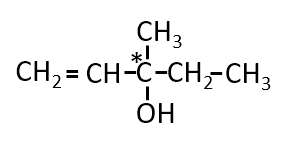
分子式がC6H12Oで表される化合物で、C=C、-OH、不斉炭素原子を持ち、二クロム酸カリウムで酸化されず、
水素を付加すると不斉炭素原子を持たない化合物ができるものの構造式を示せ。また不斉炭素原子に*をつけよ。
A-08.
二クロム酸カリウムで酸化されないということは三級アルコールです。
Q-09.
第1問 Ⅰ エ
分子式がC6H12Oで表される化合物で、C=C、不斉炭素原子を持ち、-OHを持たず、二クロム酸カリウムで酸化されず、
水素を付加すると不斉炭素原子を持たない化合物ができるものの構造式を示せ。また不斉炭素原子に*をつけよ。
A-09.
前問と異なるのは、アルコールではなくエーテルであるところです。
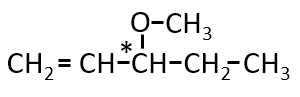
Q-10.
第1問 Ⅰ オ
構造式が次の図で表される化合物H'が環状になったときの構造式を書け。
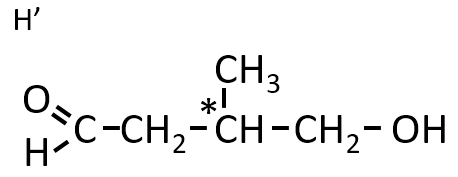
A-10.
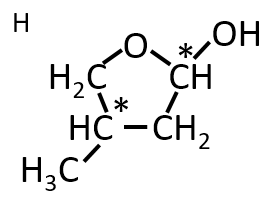
解説
単糖の鎖状構造と環状構造の関係から考えます。
H’の右端の-OHのOは環状構造の中のOとなり、左端のOHC-のOは環から飛び出した-OHのOとなります。
----↓ 第1問 Ⅱ----
第1問Ⅱは有機化学の反応の問題です。問われている反応は教科書に書いてあるレベルの非常に簡単なものですが、窒素の同位体を用いて反応機構を調べているところが通常の問題にはない新しい点といえます。
Q-11.
第1問 Ⅱ キ
原子核中の陽子の数が同じであるにもかかわらず、中性子の数が異なるものを何というか答えよ。
A-11.
同位体
Q-12.
第1問 Ⅱ ク
ニトロベンゼン(C6H5NO2)を塩酸中でスズ(Sn)と反応させたときの反応式を示せ。なお、スズはすべて塩化スズ(SnCl4)に変換さるものとする。
A-12.
2C6H5NO2 + 3Sn + 14HCl → 2C6H5NH3Cl + 3SnCl4 + 4H2O
解説
ニトロベンゼンをスズで還元するとアニリン塩酸塩ができることはよく知っていると思います。しかし、通常は係数をつけた反応式で示さず、ニトロベンゼンからアニリン塩酸塩ができる図しか見たことがないのではないかと思います。
解答の通り、反応式は係数が非常に複雑です。
Q-13.
第1問 Ⅱ ケ
化合物Mを熱した銅線に触れさせて、その銅線を炎の中に入れたところ、青緑色の炎色反応がみられた。
化合物Mについて何がわかるか答えよ。またこの反応を何というか答えよ。
A-13.
ハロゲン(Cl、Br、I)(Fを除く)が含まれている。
反応名: バイルシュタイン反応
Q-14.
第1問 Ⅱ ケ
アニリン塩酸塩を濃塩酸中で氷冷しながらNaNO2を加えてできる化合物を答えよ。
A-14.
塩化ベンゼンジアゾニウム
Q-15.
第1問 Ⅱ ケ
塩化ベンゼンジアゾニウムを分解すると何と何ができるか答えよ。
A-15.
フェノールと窒素(N2)
Q-16.
第1問 Ⅱ ケ
塩化ベンゼンジアゾニウムとフェノールを0℃で反応させたときできる化合物の構造式を示せ。
A-16.
p-ヒドロキシアゾベンゼンができる。

----↑ 第1問 Ⅱ----
----↓ 第2問 Ⅰ----
第2問 Ⅰは平衡の問題です。水素が関係する平衡の問題ですが、通常の問題と異なるのは水素吸蔵物質を共存させてあるところです。
水素の吸蔵が関係しない問題については確実に解答したいところです。
吸蔵が関係する問題では、液体の飽和蒸気圧と同じ考え方で解答できるものもあります。
問ウは水素とアルゴンの物質量は同じにしてその比率を変えたとき、どのような圧力になるかのグラフを選ぶ問題です。
状況をイメージすることができれば難しい数値の考察なしに解答できますが、そのあたりをすぐに理解でるかどうかです。
第2問 Ⅰは一問一答の題材がないので省略します。
----↑ 第2問 Ⅰ----
----↓ 第2問 Ⅱ----
第2問 Ⅱはアミノ酸や酵素を題材とした反応、反応速度に関する問題です。
簡単な問題もありますが、反応速度をアレニウスの式で表してある問サは理解するのに時間がかかってしまうと痛いです。
問シは反応速度の変化を考察する問題です。簡単なように見えますが、書いてあることを確実に整理、理解して解答に取り掛からないと間違えます。
Q-17.
第2問 Ⅱ ケ
ウレアーゼと呼ばれる酵素は、尿素(NH2)2COがアンモニアと二酸化炭素に加水分解する反応を促進する。この反応の化学反応式を示し、
反応開始時のアンモニアの生成速度は尿素の減少速度の何倍か答えよ。
A-17.
(NH2)2CO + H2O → 2NH3 + CO2
アンモニアの生成速度は尿素の減少速度の2倍
Q-18.
第2問 Ⅱ コ
H2O2(液)とH2O(液)の生成反応の熱化学方程式をそれぞれ記せ。
またH2O2(液)からH2O(液)と酸素への分解反応の反応熱を求め、有効数字2桁で答えよ。
ただし、H2O2(液)とH2O(液)の生成熱はそれぞれ187.8 kJ/mol、285.8 kJ/molとする。
A-18.
H2(気) + O2(気)= H2O2(液) + 187.8 kJ
H2(気) + 1/2 O2(気)= H2O(液) + 285.8 kJ
H2O2(液) = H2O(液) + 1/2 O2(気) + Q kJ
Q = 285.8 - 187.8 = 98.0kJ
解説
非常に基本的なことですが、熱化学方程式は両辺を=でつなぐ、物質に(気)などの状態を書く、熱量の単位はkJ/molではなくkJで書く、
など書き方のルールに忠実に従う必要があります。
----↑ 第2問 Ⅱ----
----↓ 第3問 Ⅰ----
第3問 Ⅰはモール法という滴定法を題材とした問題です。この問題は計算が大変です。
溶解度積からイオンの濃度を計算しますが、滴定で液を加えたことによって、対象としている溶液の体積が増加するため、計算する際はそれを考慮に入れなければならないのと、溶解しているイオンの濃度ではなく、モル数を聞かれているため、濃度に体積をかけて計算する必要がある点に注意が必要です。
Q-19.
第3問 Ⅰ ア
Cl-を含む液に指示薬としてクロム酸カリウム K2CrO4を加え、硝酸銀 AgNO3を滴下してCl-の濃度を求める滴定実験(モール法)はpH7から10で行う必要がある。
pH10以上で滴定を行ったときどのような反応が起こるから滴定が正確に行われなくなるか。イオン反応式を答えよ。
A-19.
2Ag+ + 2OH- → Ag2O + H2O
----↑ 第3問 Ⅰ----
----↓ 第3問 Ⅱ----
第3問 Ⅱは結晶の問題です。金属結晶の間に水素が入るという水素吸蔵合金の問題設定です。
水素吸蔵を題材にした問題は第2問Ⅰでもありました。
今年は水素吸蔵をテーマにしているのでしょうか。
問題は強烈に難しいというわけではありませんが、問キ、クの原子間同士の距離を求める問題では、どこを求めるのか正しく理解しないと間違えます。
計算量が多く、時間がかかる印象です。
第3問 Ⅱには一問一答の題材がないので省略します。
----↑ 第3問 Ⅱ----