2016年 東京大学 化学 一問一答と解説
【問題分析】
2016年の東京大学化学の問題
【一問一答】
----↓ 第1問 ----
【解答上のポイント】
第1問 Ⅰはイオン性化合物の再結晶の問題、第1問 Ⅱは液体の飽和蒸気圧の問題でした。どちらの問題も割と簡単なので、しっかり得点したい問題です。
第1問の中で注意が必要なのは第1問 Ⅰ〔問〕ウの計算問題です。
結晶化したときに水和水ができるため、結晶化したときの重量を計算する際に水和水の考慮が必要です。
与えられた条件から、溶かした十水和物と溶媒の重量を方程式を立てて求める問題ですが、十水和物の重量をxと置いてしまうと、方程式の計算がとても大変です。
計算方法としては、水和水を含まない溶質の重量をxと置いて計算します。少しの差ですが後の計算に大きな影響が出ます。
Q-01.
第1問 Ⅰ 問ア
溶解度の温度変化を利用して不純物を取り除き分離することを何というか答えよ。
A-01.
再結晶
Q-02.
第1問 Ⅰ 問イ
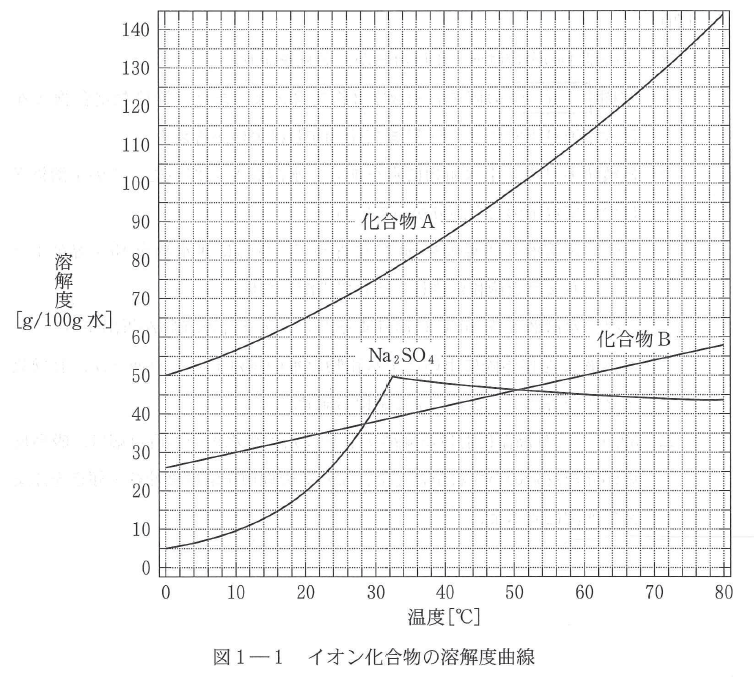
A-02.
33 g
10℃
解説
化合物Aの析出量
溶媒の水の量は135-(70+15)=50 gである。
グラフから化合物Aは30℃の時、100 gの水に対して75 g溶ける。水50 gに対して溶ける最大重量(飽和状態)をxとすると
\(\displaystyle \frac{x}{50} =\frac{75}{100}\)
\(\displaystyle x =37.5\)
したがって析出する重量は70-37.5 = 32.5 ≒33 g
化合物Aの析出量が最大となるときの温度
純粋な化合物Aが取り出せるのは、化合物Bが析出を開始する直前である。
化合物Bは50 gの水に対して15 g溶けている。すなわち100gの水に対して30 g溶けているのと同等の濃度(=溶解度)である。
グラフから、化合物Bの溶解度が30 g となるときの温度は10℃である。
----↑ 第1問 ----
----↓ 第2問 ----
【解答上のポイント】
第2問Ⅰ、Ⅱとも無機化学系の出題でした。難易度は低く、点が取りやすい問題が多かったと思います。
但し、東大らしく、説明問題では他では見たことがないような問題も出題されています。
Ⅰ-アではNH3、CO2、BF3の電子式と分子形状を答える問題が出題されました。東大は電子式を答える問題がよく出題されています。
今回の問題ではNH3とCO2は問題集で見たことがあると思いますのでよいとして、BF3は注意が必要です。
Bは価電子が3個しかなく、すべてFと結合するためBには不対電子はありません。
これまでに東京大学で電子式を答える問題として出題された中で注意すべきものとして、NO2、NO2+、NO2-等があります。
問題集にもあまり載っておらず、特殊なのでよく勉強しておく必要があります。
Ⅰ-エでは過マンガン酸カリウムの酸性液中と、中性・アルカリ性液中での反応を分けて覚えておく必要があります。
エ(2)の選択肢に記載がある黒色の沈殿(MnO2)ができるのは中性・アルカリ性液中のため、間違いです。
Ⅱは簡単な問題が多かったので平均点は高かったと思われます。
出題内容はアルカリ金属についてです。
Ⅱ-カはアルカリ金属の結合について問う問題でした。
アルカリ金属は下方に行くほど融点がどうなるかというような出題でした。
東大では結合の強さに関する問題がよく出題されています。
2018年 第2問 問ウの問題ではMgO、CaO、BaOの結晶のうち、最も融点の高いものを推定し、理由を示せ、という問題が出題されています。
Ⅱ-クはNaHにおいて、NaとHのどちらが陽イオン性が大きいかを説明する問題です。
答えとしてはHの方が電気陰性度が大きいためというような説明になると思います。
Naの方がイオン化傾向が大きいため、という答えは×です。
イオン化傾向は水の中で陽イオンになろうとする性質のことで、化合物中の電子の偏りとは違います。
Ⅱ-ケはクラウンエーテルを題材にした問題でした。クラウンエーテルを発見したペダーセンは1987年にノーベル化学賞を受賞しました。クラウンエーテルは有機合成によく使われています。
ほとんどの受験生はクラウンエーテルを見るのは初めてだと思います。1ページにわたってクラウンエーテルの問題が書いてありますが、要点がわかれば問題に対する解答は非常に簡単です。
出題内容はクラウンエーテルの中に入るイオンを推定するものでした。クラウンエーテルの穴の半径が与えられていて、ここに入るのはどのイオンかを選択するものでした。
注意するのは、クラウンエーテルの穴の半径となるのは陽イオンと酸素の半径の合計となる点です。図の下にもそのような説明が書いてありますがこれを見逃さないようにすることです。
Q-03.
第2問 Ⅰ 問ア
NH3、CO2、BF3の電子式を書け
A-03.
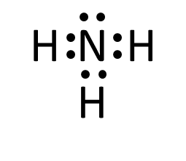
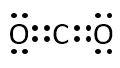
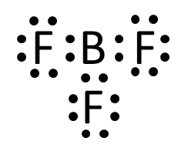
Q-04.
第2問 Ⅰ 問エ
過マンガン酸イオンの酸性と塩基性での酸化剤としての反応を示せ。
A-04.
酸性 MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
塩基性 MnO4- + 2H2O + 3e- → MnO2↓(黒) + 4OH-
Q-05.
第2問 Ⅱ 問カ
アルカリ金属は族の下に行くほど融点は高くなるか低くなるか答えよ。
A-05.
低くなる。
解説
族の下に行くほど原子半径が大きくなるので、単位体積当たりの電子密度が低くなるため、結合が弱くなるからです。
Q-04.
第2問 Ⅱ 問ク
NaHが水と反応する際の化学反応式を記せ。
A-04.
NaH + H2O → NaOH + H2
解説
この反応式は見たことがないと思いますが、Naが水の中に入ると安定してできそうなのは水酸化ナトリウム(NaOH)と推測し、反応式を作ります。
----↑ 第2問 ----
----↓ 第3問 ----
【解答上のポイント】
第3問は有機化学の問題でした。
Ⅰは有機化学の構造決定など、Ⅱはタンパク質の結合などの問題でした。
難易度は低めですが、1問1問注意して問題文を読まないと、正しい答えをかけません。
Ⅰ
問イでは「化合物Aは水酸化ナトリウム水溶液に入れても溶けないが、加熱すると溶けた」から化合物Aにある官能基を推定する必要があります。
ところで官能基とは何でしょうか。それはヒドロキシ基、カルボキシ基、アルデヒド基などですが、エステル結合、エーテル結合も基はついていなくても官能基です。
官能基は英語ではfunctional groupといいます。functional groupを日本語で解釈すると「機能的なグループ」すなわち、
有機化合物において何か特別な働きがある部分となり、-OH、-COOH、-CHOのように化合物の端にある特別な部分だけを指しているのではありません。
分子の途中にある-COO-や-O-も官能基です。
英語の方が官能基の意味をよりよく表しているように思います。
長くなりましたが、化合物Aにある官能基は分子式C10H10O4と合わせて考えるとエステル結合です。
この問題を答えるときに○○基ばかり探していると答えに至りません。細かい言葉の定義に注意しましょう。
問ウは水酸化ナトリウムと二酸化炭素の中和反応を答える問題でした。
まず第一に水酸化ナトリウムと二酸化炭素の中和反応だと気が付かなくてはいけません。
次に反応ですが
2NaOH + CO2 → Na2CO3 +H2O
としてはいけません。というのはこの問題には、pHが11.0の溶液に二酸化炭素を標準条件で1.12 mL吹き込んで中和した、という条件が付いているからです。
この条件からNaOHとCO2は1 : 1で反応していることになります。したがって反応式は
NaOH + CO2 → NaHCO3
となります。
以下はNaOHとCO2が1 : 1で反応していることを示す計算です。
NaOHとCO2が反応するときの割合を調べるためには、OH-の濃度とCO2の物質量を求める必要があります。
CO2の物質量の計算は説明するまでもないと思いますが、1.12×10-3/22.4=5.00×10-5 molと求まります。
OH-の濃度はpH=11.0からpH=-log[H+] なのでlog[H+]=-11、したがって [H+]=1.0×10-11
水のイオン積は1.0×10-14 mol2・L-2と与えられているので
[H+][OH-]=1.0×10-14から
[OH-]=1.0×10-14/10-11=1.0×10-3 mol/L
としても良いですが、もっと速く計算できるようにします。
pOH=-log[OH-]と定義すると
pH + pOH =14となります。
これを利用すると計算がもっと速くなります。
pOH=14-pH
となるため、この問題の場合はpOH=14-11=3になります。したがって
[OH-]=1.0×10-3 mol/L
とすぐに[OH-]が計算できます。
液の体積は50.0 mLのため、物質量は1.0×10-3×50/1000=5.00×10-5 molとなることから、
反応したOH-とCO2は1 : 1と分かります。
この問題はNaOHとCO2の反応を答える単純な問題ですが、反応する物質の割合を求めたり、それを計算するために与えれれている条件がpHであったり、
気体の体積であったりして計算が複雑になるようにして問題を難しくしてありますね。
Ⅱ
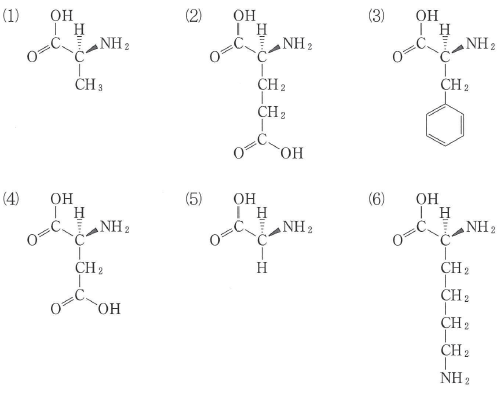
問キはL1の-NH2+-とイオン結合していると考えられる側鎖を持つものを選択肢(1)~(6)の中から選ぶ問題です。
この問題のポイントはわかりましたか?
-NH2+-とイオン結合するものなので-COO-と推測するところまでは簡単にできると思います。
しかし、すべての選択肢で-COOHがあるのでどれを選ぶべきか分かりません。
選ぶポイントは問題文にある「側鎖を持つもの」です。
またまたここで難しいのがどれが側鎖かということです。
αアミノ酸におけるα炭素に結合したカルボキシ基とアミノ基が結合してタンパク質が生成します。
タンパク質における主鎖は ・・・-NH-C-CO-NH-C-CO-NH-C-CO-・・・ のつながりの部分です。本問の選択肢はアミノ酸ですが、主鎖をHOOC-C-NH2の部分とすると、
これ以外に-COOHを持つものを選べばよいことになります。
答えは(2)と(4)です。
わかれば簡単ですが、問題文の中にある細かな条件を確実に拾っていかなければ正解にたどり着けません。