有機化学の構造決定問題の解き方
大学入試の化学において、有機分野の定番問題は有機化合物の構造決定の問題です。
いろいろな条件が並べてあって、「化合物Aの構造式を書け」というような問題です。 簡単な問題なら苦労はしませんが、難関大学によくある複雑な条件設定の場合、解法パターンを覚えて効率的に処理していかないととても時間内に解答できません。
ここでは、有機化合物の構造決定でよく見られるパターンをとおして、システマティックに解答していく方法を述べたいと思います。
この項目を何度もチェックしておくと格段に速く解答できるようになると思います。
1.分子式の決定
初めからC6H12Oなどと与えられている場合もありますが、「71.5mgのAを完全燃焼させると、143mgの二酸化炭素と、40.5mgの水が生じた。」として、炭素、水素などの割合を計算するパターンがよく見られます。
この時、例えば酸素が含まれている可能性もあるので、問題文をよく読む必要があります。
上記の例では炭素と水素の重量は下記のようにして求められます。重量を原子量で割ればモル数にすることができます。
H: \(\displaystyle 40.5 \times \frac{2}{18}=4.5\) mg
さらにAに酸素が含まれていると下記のように引き算で酸素の重量を求めます。
O: \(\displaystyle 71.5-39-4.5=28\) mg
C, H, Oの物質量比は \(\displaystyle \frac{39}{12} : \frac{4.5}{1} : \frac{4.5}{16}=3.25: 4.5: 1.75\)
4倍にすると整数になり、C : H : O = 13: 18: 7。
分子量が、例えば300以下としてあれば、分子式はC13H18O7と求まります。
もし上記の例で具体的に分子量が286と分かっていれば、下記のようにして分子内における炭素の数を直接求めることができます。
これは定番の方法なので必ず覚えておく必要があります。
C: \(\displaystyle \frac{143 \times 10^{-3}}{44} \times \frac{286}{ 71.5 \times 10^{-3} }=13 \)
1つ目の分数は、71.5 mg中にCが何モルあるかを計算する式です。
2つ目の分数は、71.5 mgを何倍すれば、化合物A 1 mol (=286 g)になるかを計算する式です。
水素も同様にして求めることができます。
H: \(\displaystyle \frac{40.5 \times 10^{-3}}{18} \times 2 \times \frac{286}{ 71.5 \times 10^{-3} }=18 \)
酸素の数をzとすると
\(\displaystyle 12 \times 13 + 1 \times 18 + 16 \times z=286\)
\(\displaystyle z=7\)
CとHを求める分数の式が分かりにくければ次のように考えるとよいです。
A、CO2、H2Oの物質量は
A: \(\displaystyle \frac{71.5 \times 10^{-3}}{286} =0.25 \times 10^{-3} mol\)
CO2: \(\displaystyle \frac{143 \times 10^{-3}}{44} =3.25 \times 10^{-3} mol\)
H2O: \(\displaystyle \frac{40.5 \times 10^{-3}}{18} =2.25 \times 10^{-3} mol\)
化合物Aの分子式をCxHyOzとおくと、Aの完全燃焼の反応式は
CxHyOz+ mO2 → xCO2 + 1/2 yH2O
係数比より
\(\displaystyle x=\frac{3.25 \times 10^{-3}}{0.25 \times 10^{-3}} =13\)
\(\displaystyle y/2=\frac{2.25 \times 10^{-3}}{0.25 \times 10^{-3}} =9\)
∴\(\displaystyle y=18\)
酸素の数zは
\(\displaystyle 12 \times 13 + 1 \times 18 + 16 \times z=286\)
\(\displaystyle z=7\)
2.不飽和度の計算
分子内に二重結合などがあるかどうかを調べます。
不飽和度の計算式は次の通りです。(詳しくは有機化合物の不飽和度の求め方を参照してください)
不飽和度=\(\displaystyle \frac{2C+2+N-H-X}{2}\)
ここで、C、N、H、Xはそれぞれ炭素C、窒素N、水素H、ハロゲン原子Xの数
また、酸素(O)や硫黄(S)が存在しても、飽和に必要な水素の数は変わらないので、計算に入れません。
不飽和であるとき、下記のa~dが分子内に存在する可能性が考えられます。
a. 二重結合
b. 三重結合
c. 環状構造
d. ベンゼン環
求める化合物にベンゼン環があるときは、たいてい問題文中に「芳香族である」というような断りが入れてあります。
特に注意したいのが「環状構造」です。不飽和であるときは、二重結合があるために、あるいは環状になっているために水素が少なくなっているのかを見極める必要があります。
3.重要な反応
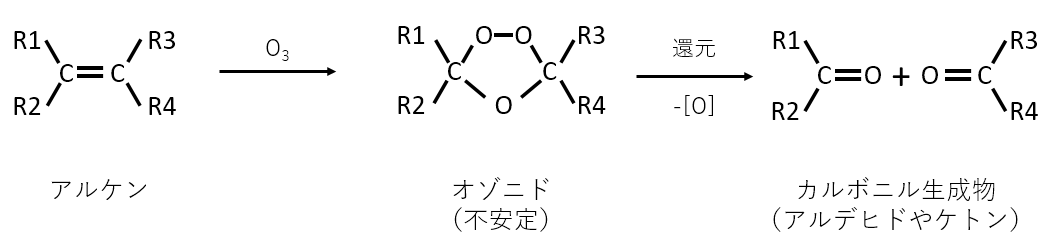
a. オゾン分解
二重結合を切って2つの化合物をつくる反応であるオゾン分解は入試によく出てきます。この反応は入試で頻出です。
高校の範囲を超えているために、たいていは問題文に説明が入れてありますが、事前に覚えておくと解答に有利です。
オゾン分解では、下の図で示すように二重結合の間に酸素が入って2つの化合物ができます。
b. 濃硫酸による脱水反応
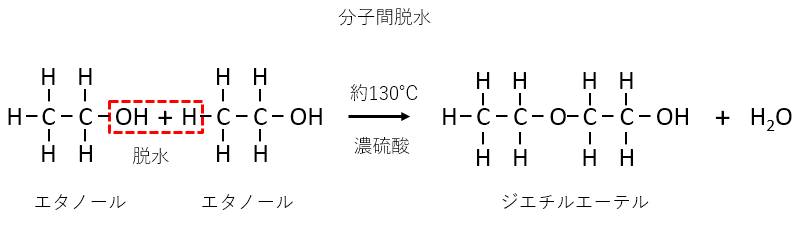
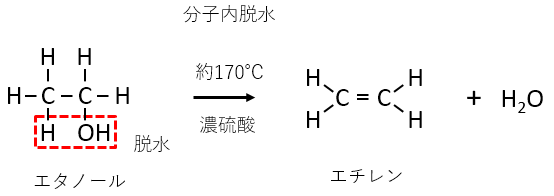
濃硫酸には脱水作用があります。硫酸ではなく濃硫酸であることに注意が必要です。
まず基本的な反応として、エタノールの分子間脱水と分子内脱水があります。
どちらが起こるかは反応温度によって決まります。温度が低い時は分子間脱水、温度が高い時は分子内脱水が起こります。
濃硫酸の反応が出てきたら脱水反応を思い出すようにしましょう。
c. 酸の強さ
塩酸≫スルホン酸>カルボン酸>炭酸>フェノール類
(語呂:スカタンフェノール)
弱酸に強酸を入れると、弱酸が遊離する。
4.条件からの部分構造の推定
ここでは問題文でよくみられる条件とそれに対応する構造を述べます。
二重結合や三重結合があります。
b. 「不飽和だが水素が付加しない」
aとは異なり-C-C-結合が環状構造でつながっています。
c. 「金属ナトリウムを加えると水素が発生する」
-OH基があります。
酸素が1個あると分かっている場合、-C-O-C-のような構造ではないということです。
d. 「ヨードホルム反応を示す」
ヨードホルム反応が起こるとき、下記のような構造があります。

CH3CO- やCH3CH(OH)- が炭素原子または水素原子と結合していないとヨードホルム反応は起きません。
Rはアルキル基、アリール基、水素です。
したがって、酢酸ではヨードホルム反応が起こらないので注意が必要です。

CH3CO- Rの構造のものがヨードホルム反応をすると、CHI3と下記の構造のものができます。CHI3はCH3CO- Rの構造において一番左のCH3のHがIに置き換わることにより生成します。下記の構造はCH3が取れて、かわりに-OHが付くことにより生成します。生成した有機化合物はCH3が取れたため、元の化合物と比べて炭素が1個減っています。

e. 「塩化鉄(Ⅲ)水溶液を加えると紫色に呈色した」
ベンゼン環に結合した-OH(フェノール性ヒドロキシ基)があります。
f. 「酢酸鉛(Ⅱ)水溶液を加えると黒色沈殿が生じた」
硫黄Sがあります。
g. 「銀鏡反応を示す、フェーリング液を還元する」
還元性があるということで、アルデヒド基(ホルミル基)-CHOがあります。
考えられる化合物
・アセトアルデヒドなどのアルデヒド類
・糖
・ギ酸 (← 忘れやすいので注意)
応用
2023年の神戸大学の問題で次のような場合がありました。
「五員環の中にエステル結合があり、エステル結合が加水分解すると還元性を持つようになる」という設定でした。
エステル結合に結合している炭素が二重結合を持っており、加水分解すると炭素の二重結合に-OH基が結合した形になります。これはエノールといい、不安定なので、アルデヒド基に変化して還元性を持つようになります。

h. 「アルコールの酸化」
アルコールの-OH基があるとき、第一、第二、第三級アルコールによって反応が異なります。
・酸化するとアルデヒドになり、次にカルボン酸になった。 → 第一級アルコール
・酸化するとケトンになった → 第二級アルコール
・酸化されなかった → 第三級アルコール

i. 「濃硫酸を反応させる」 濃硫酸は脱水作用があります。すなわち分子中の-OHとHが取れてH2Oが生成します。
分子内の-OHとHがH2Oとなって取れるとき、元の分子には >C=C< の二重結合ができます。
j. 「加水分解した」 エステル結合 R−COO−R'、またはアミド結合 R-CO-NH-R' がある。
エステルの加水分解はよく見るため、知っている人は多いと思いますが、アミド結合も加水分解します。
k. 「加水分解してできる化合物の分子式の計算」
例
化合物A(C13H18O7)を加水分解して、化合物B(C6H12O6)ができるとき、化合物Bと共にできる化合物Cの分子式を求めよ。
計算方法
C13H18O7 + H2O - C6H12O6 = C7H8O2
加水分解なので、C13H18O7に H2Oを足し、化合物Bの分子式を引く。
加水分解に関連して、分子式を求める問題はよく出題されるので、やり方を覚えておかなければなりません。
l. 「加水分解した時、不安定な中間生成物を経て、安定な化合物ができた」
「不安定な中間生成物」はC=Cの二重結合に-OHが付いたエノールというものです。エノールは不安定なため、炭素はC-Cの単結合(一重結合)となり、代わりにC=O結合ができます。
例えば
・平成29年度試行調査 第3問 問3
・2017年 東京大学 第1問
・2021年 名古屋大学 問題Ⅲ
の問題にでてきた表現です。
m. 「分子式がC10H10O4である芳香族化合物Aは水酸化ナトリウム水溶液にはほとんど解けなかったが、加熱すると化学反応が起こり、完全に溶解した」
(2016年 東京大学 第3問)
この問題の条件では、室温では水酸化ナトリウムとは反応していないので、カルボキシ基やフェノール性ヒドロキシ基はありません。
温度を上げると水酸化ナトリウムと反応、すなわち、けん化が起こっているので、エステル結合があります。